题目内容
如何除去括号内的杂质,指出所用除杂试剂及分离方法:
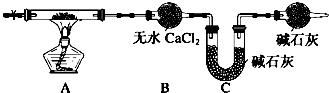
(1)H2(H2O):
(2)CO2(CO):
(3)CO2(HCl):
(4)CaCl2(CaCO3):
(5)FeSO4(CuSO4): .
(1)H2(H2O):
(2)CO2(CO):
(3)CO2(HCl):
(4)CaCl2(CaCO3):
(5)FeSO4(CuSO4):
考点:物质分离、提纯的实验方案设计
专题:化学实验基本操作
分析:(1)可用浓硫酸干燥;
(2)在加热条件下CO与CuO反应;
(3)HCl与饱和碳酸氢钠溶液反应;
(4)CaCO3可与盐酸反应;
(5)铁可置换出铜.
(2)在加热条件下CO与CuO反应;
(3)HCl与饱和碳酸氢钠溶液反应;
(4)CaCO3可与盐酸反应;
(5)铁可置换出铜.
解答:
解:(1)氢气中混有水蒸气,可用浓硫酸干燥,故答案为:浓硫酸,洗气;
(2)在加热条件下CO与CuO反应,故答案为:CuO,加热;
(3)HCl与饱和碳酸氢钠溶液反应生成二氧化碳气体,可用洗气的方法除杂,故答案为:饱和碳酸氢钠溶液,洗气;
(4)CaCO3可与盐酸反应,故答案为:盐酸,溶解;
(5)铁可置换出铜,且不引入新杂质,故答案为:Fe,过滤.
(2)在加热条件下CO与CuO反应,故答案为:CuO,加热;
(3)HCl与饱和碳酸氢钠溶液反应生成二氧化碳气体,可用洗气的方法除杂,故答案为:饱和碳酸氢钠溶液,洗气;
(4)CaCO3可与盐酸反应,故答案为:盐酸,溶解;
(5)铁可置换出铜,且不引入新杂质,故答案为:Fe,过滤.
点评:本题考查物质的分离与除杂,为高频考点,侧重于学生的分析能力和实验能力的考查,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键,难度不大.

练习册系列答案
相关题目
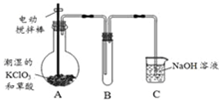 二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
