题目内容
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z与M同主族:X+与M2-具有相同的电子层结构:离子半径:Z2->W-;Y单质晶体熔点高硬度大,是一种重要的半导体材料.试回答下列问题:
(1)五种元素中原子半径最大的元素是 (写元素符号)
(2)X与M两元素以原子个数1:1形成的化合物的电子式为 .
(3)写出由YM2制取Y单质的化学方程式 .
(4)化合物Z2W2遇水剧烈反应,产生黄色沉淀和刺激性气味的气体,其反应的方程式为 .
(5)W、M两元素形成的单质和化合物常用来杀菌消毒,试举例 (任写两种).
(1)五种元素中原子半径最大的元素是
(2)X与M两元素以原子个数1:1形成的化合物的电子式为
(3)写出由YM2制取Y单质的化学方程式
(4)化合物Z2W2遇水剧烈反应,产生黄色沉淀和刺激性气味的气体,其反应的方程式为
(5)W、M两元素形成的单质和化合物常用来杀菌消毒,试举例
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Y的单质晶体熔点高、硬度大,是一种重要的半导体材料可知Y为Si,则X、Y、Z、W都在第三周期,再由X+与M2-具有相同的电子层结构;离子半径:Z2->W-;依次推出X为Na,M为O,Z为S,W为Cl,据此解答各小题即可.
解答:
解:依据分析可知:X为钠,Y为硅,Z为硫,W为氯,M为氧,
(1)电子层数越多,半径越大,同一周期,原子序数越小,半径越大,故Na、Si、S、Cl、O五种元素中原子半径最大的元素是Na,故答案为:Na;
(2)Na与O两元素以原子个数1:1形成的化合物为过氧化钠,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,
,
故答案为: ;
;
(3)由SiO2制取Si单质,是采用高温下利用碳还原的方法,化学方程式为:SiO2+2C
Si+2CO↑,故答案为:SiO2+2C
Si+2CO↑;
(4)S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,无色刺激性气味气体除氯化氢外,依据氧化还原反应的元素化合价变化守恒推断,化合价降低的生成黄色沉淀为单质硫,化合价升高的生成二氧化硫气体,依据原子守恒、电子守恒写出化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑,故答案为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;
(5)Cl、O两元素形成的单质氯气具有强氧化性,常用来杀菌消毒,ClO2是一种新型消毒剂,故答案为:Cl2、ClO2.
(1)电子层数越多,半径越大,同一周期,原子序数越小,半径越大,故Na、Si、S、Cl、O五种元素中原子半径最大的元素是Na,故答案为:Na;
(2)Na与O两元素以原子个数1:1形成的化合物为过氧化钠,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
 ,
,故答案为:
 ;
;(3)由SiO2制取Si单质,是采用高温下利用碳还原的方法,化学方程式为:SiO2+2C
| ||
| ||
(4)S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,无色刺激性气味气体除氯化氢外,依据氧化还原反应的元素化合价变化守恒推断,化合价降低的生成黄色沉淀为单质硫,化合价升高的生成二氧化硫气体,依据原子守恒、电子守恒写出化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑,故答案为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;
(5)Cl、O两元素形成的单质氯气具有强氧化性,常用来杀菌消毒,ClO2是一种新型消毒剂,故答案为:Cl2、ClO2.
点评:本题考查位置、结构、性质的关系和应用,寻找本题的突破点为Y是解答本题的关键,然后利用元素化合物知识来解答即可.

练习册系列答案
相关题目
将下列各种液体分别与溴水混合并振荡,不能发生反应,静置后溶液分层,且溴水层几乎无色的是( )
| A、乙酸 | B、乙烯 | C、苯 | D、酒精 |
我们所吃的豆腐是一种( )
| A、糖类 | B、蛋白质 | C、脂肪 | D、淀粉 |

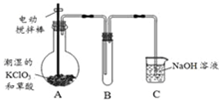 二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.
二氧化氯(ClO2)在常温下是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得.某学生拟用如图所示装置模拟工业制取并收集ClO2.