题目内容
17.市售盐酸的密度为1.18g/mL,HCl的含量为36%~38%,欲用此盐酸配制500mL0.1mol/L的HCl溶液,应量取多少毫升?分析 依据c=$\frac{1000ωρ}{M}$计算浓盐酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓盐酸的体积.
解答 解:密度为1.18g/mL,HCl的含量为36%~38%,物质的量浓度约为:$\frac{1000×1.18×36%}{36.5}$≈11.8mol/L,设需要浓盐酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:11.8mol/L×V=500mL×0.1mol/L,解得V=4.2mL;
故答案为:4.2mL.
点评 本题考查了物质的量浓度有关计算,明确物质的量浓度与质量百分数浓度之间换算,熟悉溶液稀释过程中溶质的物质的量不变是解题关键,题目难度不大.

练习册系列答案
相关题目
5. 甲、乙、丙、丁是四中含有同一元素的物质,其中甲是单质,丁是其最高化合物对应的水化物,它们之间有如图所示的转化关系,则丁不可能是( )
甲、乙、丙、丁是四中含有同一元素的物质,其中甲是单质,丁是其最高化合物对应的水化物,它们之间有如图所示的转化关系,则丁不可能是( )
 甲、乙、丙、丁是四中含有同一元素的物质,其中甲是单质,丁是其最高化合物对应的水化物,它们之间有如图所示的转化关系,则丁不可能是( )
甲、乙、丙、丁是四中含有同一元素的物质,其中甲是单质,丁是其最高化合物对应的水化物,它们之间有如图所示的转化关系,则丁不可能是( )| A. | NaOH | B. | H2SiO3 | C. | HNO2 | D. | H2SO4 |
12.对“AgCl(s)?Ag+(aq)+Cl-(aq)”的理解正确的是( )
| A. | 说明AgCl没有完全电离,AgCl是弱电解质 | |
| B. | 说明溶解的AgCl已完全电离,是强电解质 | |
| C. | 说明Ag+与Cl-反应不能完全进行到底 | |
| D. | 说明AgCl(s)与Ag+、Cl-共存,v溶解=v沉淀=0 |
6.在稀硫酸中放入一块镀层被严重损坏的镀锌铁板(俗称白铁片),反应放出气体的速率是( )
| A. | 时快时慢 | B. | 先慢后快 | C. | 先快后慢 | D. | 保持不变 |
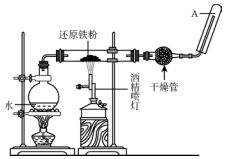 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应,应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.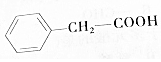 苯乙酸
苯乙酸 .
.
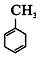 的官能团名称为碳碳双键.
的官能团名称为碳碳双键. 的系统命名为2-丙酮酸,则A的名称是3-丁酮酸.
的系统命名为2-丙酮酸,则A的名称是3-丁酮酸.
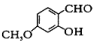 中能与稀NaOH溶液反应的官能团是羟基.检验该官能团的方法是取少量样品,加入氯化铁溶液,如果显紫色,则说明含有酚羟基.
中能与稀NaOH溶液反应的官能团是羟基.检验该官能团的方法是取少量样品,加入氯化铁溶液,如果显紫色,则说明含有酚羟基.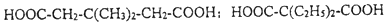 .
.
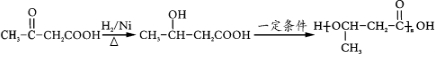 .(无机试剂任用)
.(无机试剂任用)