题目内容
16.炼铁、炼钢过程中,先被氧化后被还原的元素是( )| A. | 炼铁过程中的铁元素 | B. | 炼铁过程中的氧元素 | ||
| C. | 炼铁过程中的碳元素 | D. | 炼钢过程中的铁元素 |
分析 炼钢过程中反应原理:Fe+O2$\frac{\underline{\;高温\;}}{\;}$FeO、FeO+C$\frac{\underline{\;高温\;}}{\;}$Fe+CO 2FeO+Si$\frac{\underline{\;高温\;}}{\;}$2Fe+SiO2.结合元素的化合价变化解答.
解答 解:炼钢过程中反应原理:Fe+O2$\frac{\underline{\;高温\;}}{\;}$FeO、FeO+C$\frac{\underline{\;高温\;}}{\;}$Fe+CO 2FeO+Si$\frac{\underline{\;高温\;}}{\;}$2Fe+SiO2.
反应中C元素化合价升高,Fe元素发生Fe-FeO-Fe的一系列反应中,则Fe元素既失去电子也得到电子,所以既被氧化又被还原,
故选D.
点评 本题考查了氧化还原反应,把握化工生产中高炉炼铁所涉及的化学反应是解题的关键,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
6.下列物质:①BeCl2 ②C2H4 ③P4 ④BF3 ⑤NF3 ⑥H2O2,其中含极性键的非极性分子是( )
| A. | ①③④ | B. | ②③⑥ | C. | ①②④ | D. | ③④⑤ |
7.下列反应中,属于吸热反应的是( )
| A. | Na与H2O的反应 | B. | Al与Fe2O3的反应 | ||
| C. | 石灰石高温分解 | D. | NaOH与HCl的反应 |
4.某合成气的主要成分是一氧化碳和氢气,可用于合成甲醚等清洁燃料.由天然气获得该合成气过程中可能发生的反应有:
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.
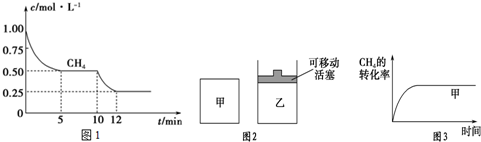
反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度.反应①平衡常数表达式为$\frac{c(CO)•c({H}_{2})^{3}}{c(C{H}_{4})•c({H}_{2}O)}$.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应③中△H3=-41.2kJ/mol.800℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见表:
此时反应③中正、逆反应速率的关系式是a(填代号).
a.v正>v逆 b.v正<v逆 c.v正=v逆 d.无法判断.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1=+206.1kJ•mol-1
②CH4(g)+CO2(g)?2CO(g)+2H2(g)△H2=+247.3kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得CH4的物质的量浓度随反应时间的变化如图1所示.

反应进行的前5min内,v(H2)=0.3mol/(L•min);10min时,改变的外界条件可能是升高温度.反应①平衡常数表达式为$\frac{c(CO)•c({H}_{2})^{3}}{c(C{H}_{4})•c({H}_{2}O)}$.
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的CH4和CO2,使甲、乙两容器初始容积相等.在相同温度下发生反应②,并维持反应过程中温度不变.已知甲容器中CH4的转化率随时间的变化如图3所示,请在图3中画出乙容器中CH4的转化率随时间变化的图象.
(3)反应③中△H3=-41.2kJ/mol.800℃时,反应③的平衡常数K=1,测得该温度下密闭容器中某时刻各物质的物质的量见表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v正>v逆 b.v正<v逆 c.v正=v逆 d.无法判断.
11.下列说法正确的是( )
| A. | 电子离核越近,能量越高 | |
| B. | 原子核外电子的运动没有规律 | |
| C. | 在多电子原子中,核外电子分层排布 | |
| D. | 电子一般尽可能排布在能量高的电子层中 |
1.下列颜色变化与氧化还原反应无关的是( )
| A. | 长期放置的苯酚晶体变红 | B. | 硝酸银晶体光照后变黑 | ||
| C. | 氢氧化亚铁变灰绿再变红褐 | D. | 二氧化碳气体冷却后变淡 |
8.目前工业上多用CO制备甲酸,其主要过程如下:
流程一:
流程二:
下列说法正确的是( )
流程一:

流程二:

下列说法正确的是( )
| A. | 反应①、③的原子利用率均为100% | |
| B. | 两种流程最终分离HCOOH都用洗涤液分液法 | |
| C. | 从原料充分利用角度看,流程二比流程一更优 | |
| D. | 两种流程总反应均为CO+H2O→HCOOH |
5.有关晶体的下列说法中正确的是( )
| A. | 原子晶体中共价键越强,熔点越高 | |
| B. | 分子晶体中分子间作用力越大,分子越稳定 | |
| C. | 冰熔化时水分子中共价键发生断裂 | |
| D. | CaCl2晶体中含有两种化学键 |
6. 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
(1)已知:2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ/mol
请写出CH4燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)在不同温度下反应CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K如下表:
①该反应的△H<0.(填“>”、“=”或“<”).
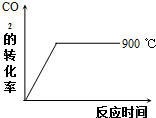
②900℃时发生上述反应,CO2的转化率随时间变化如图所示,若到达平衡后加压,则H2的转化率将(填“增大”、“减小”或“不变”,下同)不变,正反应速率将增大.
其他条件相同时,请在图中画出750℃时CO2的转化率随时间变化的示意图.
③在900℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是(填编号)AD,平衡后与C中各物质的百分含量相等的组有BD(填编号)
(3)以二甲醚(CH3OCH3)、空气、KOH溶液为原料可设计为燃料电池
①放电时,负极电极反应式:CH3OCH3-12e-+16OH-=2CO32-+11H2O.
②假设该燃料电池中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).
 碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:
碳及其化合物在科技、社会生产、生活中有着广泛的应用.请按要求回答下列问题:(1)已知:2CH4(g)+3O2(g)═2CO(g)+4H2O(l)△H1=-1214.6kJ/mol
2CO(g)+O2(g)═2CO2(g)△H2=-566kJ/mol
请写出CH4燃烧热的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ/mol.
(2)在不同温度下反应CO2(g)+H2(g)?CO(g)+H2O(g)的平衡常数K如下表:
| 温度/℃ | 600 | 750 | 900 | 1100 | 1250 |
| 平衡常数K | 2.5 | 1.6 | 1 | 0.9 | 0.6 |
②900℃时发生上述反应,CO2的转化率随时间变化如图所示,若到达平衡后加压,则H2的转化率将(填“增大”、“减小”或“不变”,下同)不变,正反应速率将增大.
其他条件相同时,请在图中画出750℃时CO2的转化率随时间变化的示意图.
③在900℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是(填编号)AD,平衡后与C中各物质的百分含量相等的组有BD(填编号)
| A | B | C | D | E | |
| n(CO2) | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
①放电时,负极电极反应式:CH3OCH3-12e-+16OH-=2CO32-+11H2O.
②假设该燃料电池中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为6.72L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+).