题目内容
下列各反应中电子转移方向和数目表示正确的是( )
A、 |
B、 |
C、 |
D、 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:化合价升高的元素的原子失去电子,化合价降低的元素的原子得到电子,得失电子数目相等,失去多少电子化合价就升高几价,得到多少电子化合价就降低几价,氧化还原反应中得失电子数目相等.
解答:
解:A、根据化合价不能交叉的原则,氯酸钾中氯元素的化合价应从+5价降到0价,盐酸中氯元素的化合价应从-1价升高到0价,转移电子数是5mol,即 ,故A错误;
,故A错误;
B、在 2Na2O2+2CO2═2Na2CO3+O2反应中,只有Na2O2中O元素的化合价发生变化,分别由-1价变化为0价和-2价,用双线桥法可表示为 ,故B正确;
,故B正确;
C、反应中化合价降低的元素是H元素,反应物H2O为该反应的氧化剂,化合价升高的元素是Na元素,金属钠为还原剂,用单线桥表示电子转为: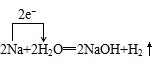 ,故C错误;
,故C错误;
D、铝和氢氧化钠、水反应生成偏氯酸钠和氢气,铝失电子发生氧化反应,水得电子发生还原反应,转移电子数为6,用单线桥表示电子转为:
 ,故D错误.
,故D错误.
故选B.
 ,故A错误;
,故A错误;B、在 2Na2O2+2CO2═2Na2CO3+O2反应中,只有Na2O2中O元素的化合价发生变化,分别由-1价变化为0价和-2价,用双线桥法可表示为
 ,故B正确;
,故B正确;C、反应中化合价降低的元素是H元素,反应物H2O为该反应的氧化剂,化合价升高的元素是Na元素,金属钠为还原剂,用单线桥表示电子转为:
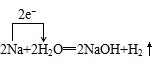 ,故C错误;
,故C错误;D、铝和氢氧化钠、水反应生成偏氯酸钠和氢气,铝失电子发生氧化反应,水得电子发生还原反应,转移电子数为6,用单线桥表示电子转为:
 ,故D错误.
,故D错误.故选B.
点评:本题考查氧化还原反应的电子转移,难度中等,根据判断准化合价变化以及变化的原子数目.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成甲烷燃料电池.已知通入CH4的一极,其电极反应式是:CH4+10OH--8e-=CO32-+7H2O;通入O2的另一极,其电极反应式是:O2+2H2O+4e-=4OH-,下列叙述不正确的是( )
| A、通入CH4的电极为负极 |
| B、正极发生还原反应 |
| C、此电池工作时溶液中阴离子向正极移动 |
| D、该电池使用一段时间后应补充KOH |
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
| A、热的稀硫酸 |
| B、不用稀硫酸,改用98%浓硫酸 |
| C、滴加少量AgNO3溶液 |
| D、不用铁片,改用铁粉 |
下列反应的离子方程式书写正确的是( )
A、实验室用氯化铵和氢氧化钙制氨气:NH4++OH-
| ||||
| B、FeCl3溶液中加入过量的HI溶液:Fe3++2I-=Fe2++I2 | ||||
| C、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | ||||
| D、酸化NaNO2溶液:NO2-+H+=HNO2 |
主族元素在周期表中的位置,取决于该元素原子的( )
| A、相对原子质量和质子数 |
| B、次外层电子数和电子层数 |
| C、最外层电子数和次外层电子数 |
| D、电子层数和最外层电子数 |
