题目内容
14.能在有机物分子中直接引入官能团羟基的反应类型有ACD(填序号)A.取代反应 B.消去反应 C.加成反应 D.水解反应
写出其中一种的任意一个反应的化学方程式:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.
分析 酯化反应、消去反应一般是脱HX或H2O,会消除羟基;而-CHO可加氢(既是加成反应又是还原反应)生成-CH2OH,酯的水解可生成醇-OH,卤代烃水解可以生成醇,水解反应属于取代反应.
解答 解:A.取代反应可以引入羟基,例如卤代烃的水解反应、酯的水解反应,故A正确;
B.消去反应是消除羟基,不会引入羟基,故B错误;
C.加成反应可以引入羟基,例如乙烯水化制乙醇,故C正确;
D.水解反应可引入羟基,如酯的水解反应生成醇,故D正确;
烯烃的加成反应可以在结构中直接引入-OH:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.
故答案为:ACD;CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.
点评 本题考查了有关有机物合成知识,主要涉及羟基的引入,题目难度不大,注意把握官能团的性质和转化即可解答该题.

练习册系列答案
相关题目
4.欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6H2O
(2)焦炭可用于制取水煤气.测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ•mol-1.
(3)工业上在恒容密闭容器中用下列反应合成甲醇:
CO(g)+2H2(g)$?_{加热}^{催化剂}$CH3OH(g)△H=akJ/mol.
如表所列数据是反应在不同温度下的化学平衡常数(K).
①判断反应达到平衡状态的依据是BD.
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2mol CO和一定量的H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则以H2表示的反应速率v(H2)=0.16mol/(L•min).
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,其正极反应式:O2+2CO2+4e-═2CO32-,则负极反应式:2CO-4e-+2CO32-=4CO2.
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)═BaCO3(s)+SO42-(aq).已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=2.5×10-9.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5 C+4 KMnO4+6 H2SO4→5CO2↑+4MnSO4+2K2SO4+6H2O
(2)焦炭可用于制取水煤气.测得12g碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ•mol-1.
(3)工业上在恒容密闭容器中用下列反应合成甲醇:
CO(g)+2H2(g)$?_{加热}^{催化剂}$CH3OH(g)△H=akJ/mol.
如表所列数据是反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的平均相对分子质量不变
C.混合气体的密度不变
D.CH3OH、CO、H2的浓度都不再发生变化
②某温度下,将2mol CO和一定量的H2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则以H2表示的反应速率v(H2)=0.16mol/(L•min).
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650℃下工作的燃料电池,其正极反应式:O2+2CO2+4e-═2CO32-,则负极反应式:2CO-4e-+2CO32-=4CO2.
(5)向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生反应:BaSO4(s)+CO32-(aq)═BaCO3(s)+SO42-(aq).已知某温度下该反应的平衡常数K=4.0×10-2,BaSO4的Ksp=1.0×10-10,则 BaCO3的溶度积Ksp=2.5×10-9.
2.在元素周期表中,所含元素种类最多的族是( )
| A. | Ⅷ族 | B. | ⅠA族 | C. | 0族 | D. | ⅢB族 |
9.下列关于有机化合物的说法正确的是( )
| A. | 塑料、天然橡胶都是高分子化合物 | |
| B. | 乙烯、聚乙烯和苯分子中均含有碳碳双键 | |
| C. | 棉花、羊毛、蚕丝均属于天然纤维素 | |
| D. | 乙酸和乙醇可用Na2CO3溶液加以区别 |
19.下列有关化学键的说法正确的是( )
| A. | 化学键主要包括离子键、共价键和氢键等 | |
| B. | 离子键是阴、阳离子通过静电作用而形成的化学键 | |
| C. | 任何离子键在形成过程中必定有电子的得与失 | |
| D. | 非金属元素的原子之间不可能形成离子键 |
6.有机化合物 中不含有的基团(或官能团)是( )
中不含有的基团(或官能团)是( )
 中不含有的基团(或官能团)是( )
中不含有的基团(或官能团)是( )| A. | 烃基 | B. | 醛基 | C. | 羟基 | D. | 羧基 |
3.反应4A(s)+3B(g)?2C(g)+D(g),经2min后,B的浓度减少了0.6mol•L-1.对此反应速率的叙述正确的是( )
| A. | 用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示反应的速率,其比值是3:2:1 | |
| C. | 在2 min末时的反应速率,用反应物B来表示是0.3 mol•L-1•min-1 | |
| D. | 在这2 min内用B和C表示的反应速率的值都是相同的 |
4.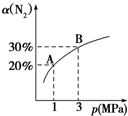 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
 某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )
某温度下,对于反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,N2的平衡转化率(α)与体系总压强(p)的关系如图所示.下列说法正确的是( )| A. | 平衡状态由A变到B时,平衡常数K(A)=K(B) | |
| B. | 将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ | |
| C. | 升高温度,逆反应速率增大,正反应速率减小 | |
| D. | 上述反应达到平衡后,增大H2浓度,平衡正向移动,H2转化率增大 |