题目内容
6.有机化合物 中不含有的基团(或官能团)是( )
中不含有的基团(或官能团)是( )| A. | 烃基 | B. | 醛基 | C. | 羟基 | D. | 羧基 |
分析  为甲酸,含-COOH、-CHO,以此来解答.
为甲酸,含-COOH、-CHO,以此来解答.
解答 解: 为甲酸,含-COOH、-CHO,且-COOH中含-OH,则含羧基、醛基、羟基,不含烃基,
为甲酸,含-COOH、-CHO,且-COOH中含-OH,则含羧基、醛基、羟基,不含烃基,
故选A.
点评 本题考查有机物的官能团,为高频考点,把握常见物质中的官能团为解答的关键,侧重分析与应用能力的考查,注意烃基不是官能团,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列性质的递变中,正确的是( )
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、NaOH、KOH的碱性依次减弱 | ||
| C. | NH3、H2O(气态)、HF的稳定性依次减弱 | D. | Cl2、Br2、I2的氧化性依次增强 |
17.下列叙述中正确的是(NA为阿伏加德罗常数)( )
| A. | 1.7 g的羟基中含有的电子数为NA | |
| B. | 标准状况下,11.2 L四氯化碳所含的原子数为2NA | |
| C. | 常温常压下,18 g H2O含有的原子数为3NA | |
| D. | 5.6 g金属铁变为离子时失去的电子数为0.2NA |
1.列有关化学用语表达不正确的是( )
| A. | 氨气分子的电子式: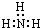 | B. | CS2分子的结构式:S═C═S | ||
| C. | S2-的结构示意图: | D. | CH4的分子模型示意图为: |
11.下列应用或事实中,与胶体的制备或性质没有关系的是( )
| A. | 皂化反应后,加入氯化钠细粒,发生盐析 | |
| B. | 黄河入海口沙洲的形成与用卤水点豆腐 | |
| C. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| D. | 氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |
18.某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积),关于该固体混合物,下列说法不正确的是( )


| A. | 一定含有Al,其质量为2.7g | |
| B. | 一定不含有FeCl2,含有少量AlCl3 | |
| C. | 混合物中含有0.05molMgCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
15.某同学根据外界条件对化学反应速率的影响原理,设计了硫代硫酸钠与硫酸反应有关实验,
实验过程的数据记录如下表,请结合表中信息,回答有关问题:
(1)写出上述反应的离子方程式S2O32-+2H+═S↓+SO2↑+H2O.
(2)①能说明温度对该反应速率影响的组合比较是BD;(填实验序号)
②A和B、A和C的组合比较所研究的问题是相同温度条件下浓度对该反应速率的影响.
(3)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小的可能原因:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
实验过程的数据记录如下表,请结合表中信息,回答有关问题:
| 实验序号 | 反应温度(℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(2)①能说明温度对该反应速率影响的组合比较是BD;(填实验序号)
②A和B、A和C的组合比较所研究的问题是相同温度条件下浓度对该反应速率的影响.
(3)教材是利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小的可能原因:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
16.能正确表示下列反应的离子方程式是( )
| A. | 氢氧化钡溶液与过量稀硫酸反应:Ba2++OH-+SO42-+H+=H2O+BaSO4↓ | |
| B. | 碳酸氢钙与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| C. | 氯化镁溶液与过量的氨水反应:Mg2++2OH-=Mg(OH)2↓ | |
| D. | 稀硫酸与过量的铁屑反应:2Fe+6H+=2Fe3++3H2↑ |