题目内容
12.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol25℃时,有体积均为2L的甲、乙两个相同的密闭容器,向甲容器中加入1mol N2和3mol H2,经过3min在25℃下达到平衡时放出Q1kJ的热量;向乙容器中加入2molNH3,一段时间后在25℃下达到平衡时吸收Q2kJ的热量,且Q1=3Q2.(1)下列情况表明反应已达到平衡状态的有BC.
A.气体的密度不再变化
B.断裂1molN≡N键的同时断裂6molN-H
C.气体的平均相对分子质量不再变化
D.氮气的生成速率与氨气的生成速率相等
(2)Q2=23.1kJ
(3)甲容器中达到平衡时,H2的平均反应速率为0.0375mol/(L•min);达到平衡后,若再向甲容器中加入0.25mol N2、0.75mol H2、1.5mol NH3,经过一段时间在25℃下重新达到平衡,则平衡常数K=正反应方向.(保留1位小数)
分析 (1)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(2)甲与乙为完全等效平衡,平衡时相同组分的物质的量相等,各组分起始物质的量等于化学计量数,故Q2+Q1=92.4,结合平衡时Q1=3Q2计算;
(3)平衡时Q1=3Q2,由于Q2+Q1=92.4kJ,故Q1=69.3kJ,则甲中转化的氮气为$\frac{69.3kJ}{92.4kJ/mol}$=0.75mol,则:
N2(g)+3H2(g)═2NH3(g)
起始量(mol):1 3 0
转化量(mol):0.75 2.25 1.5
平衡量(mol):0.25 0.75 1.5
根据v=$\frac{△c}{△t}$计算v(H2);
达平衡后,再向甲容器中加入0.25mol N2、0.75mol H2、1.5mol NH3,等效为在原平衡基础上增大压强,平衡向气体体积减小的方向移动.
解答 解:(1)A、气体的密度等于质量和体积的比值,始终是一个定值,密度不再变化的状态不一定平衡,故错误;
B、断裂1molN≡N键的同时断裂6molN-H键,而断裂1molN≡N键会生成6molN-H键,氨气的生成与消耗速率相等,反应到达平衡,故正确;
C、混合气体总质量不变,随反应进行混合气体物质的量发生变化,平均相对分子质量发生变化,则气体的平均相对分子质量不再变化,说明到达平衡,故正确;
D.氮气的生成速率与氨气的生成速率相等,不能说明正逆反应速率相等,故D错误;
故选:BC;
(2)甲与乙为完全等效平衡,平衡时相同组分的物质的量相等,各组分起始物质的量等于化学计量数,故Q2+Q1=92.4,平衡时Q1=3Q2,联立解得Q2=23.1kJ,
故答案为:23.1;
(3)平衡时Q1=3Q2,由于Q2+Q1=92.4kJ,故Q1=69.3kJ,则甲中转化的氮气为$\frac{69.3kJ}{92.4kJ/mol}$=0.75mol,则:
N2(g)+3H2(g)═2NH3(g)
起始量(mol):1 3 0
转化量(mol):0.75 2.25 1.5
平衡量(mol):0.25 0.75 1.5
则v(H2)=$\frac{\frac{2.25mol}{2L}}{3min}$=0.375mol/(L.min),
达平衡后,再向甲容器中加入0.25mol N2、0.75mol H2、1.5mol NH3,等效为在原平衡基础上增大压强,正反应为气体体积减小的反应,平衡正向进行,
故答案为:0.0375;正反应方向.
点评 本题考查化学平衡计算,(2)中注意规律的归纳总结,(3)中注意利用等效思想解答,也可以利用浓度商与平衡常数相对大小进行判断,难度中等.

| A. | Na2CO3遇少量酸可转化为NaHCO3 | |
| B. | 在水中的溶解度Na2CO3比NaHCO3大 | |
| C. | NaHCO3能与Ca(OH)2溶液反应,而Na2CO3不能 | |
| D. | 与同浓度的盐酸反应时,NaHCO3比Na2CO3剧烈 |
| A. | 标准状况下生成N的体积为$\frac{22.4(n-m)}{51}$L | |
| B. | 沉淀中OH-的质量为17bVg | |
| C. | 恰好溶解后溶液中的NO3-的物质的量为$\frac{bV}{1000}$mol | |
| D. | 与合金反应的硝酸的物质的量为($\frac{n-m}{51}$+$\frac{bV}{1000}$)mol |
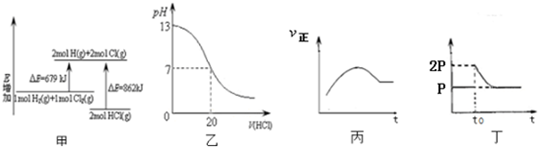
| A. | 图甲表示H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=+183 kJ/mol | |
| B. | 图乙表示室温时用0.1 mol/L盐酸滴定20 mL 0.1 mol/LNaOH溶液,溶液pH变化 | |
| C. | 图丙表示向恒容绝热的密闭容器中通入A和B,发生2A (g)+B (g)?2C(g)反应,其正反应速率随时间变化的示意图,则该反应为吸热反应 | |
| D. | 图丁表示在恒温密闭容器中,2BaO2(s)?2BaO(s)+O2(g)达到平衡,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡过程体系压强的变化 |
| A. | 24克金刚石中含有的碳碳键数目为4NA | |
| B. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| C. | 1L1mol•L-1饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶体粒子数为NA | |
| D. | 120克熔融的NaHSO4中含有的离子数为3NA |
| A. | 质子数为7、中子数为7的氮原子:${\;}_7^{14}$N | |
| B. | 氮原子的结构示意图: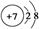 | |
| C. | 氨气分子的电子式: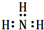 | |
| D. | 对硝基甲苯的结构简式: |
| A. | NO2溶于水:3NO2+H2O=H++NO3-+2NO | |
| B. | NaClO溶液中ClO-的水解:ClO-+H2O=HClO+OH- | |
| C. | 酸性条件下,用H2O2将I-转化为I2:H2O2+2I-+2H+=I2+2H2O | |
| D. | 氯化铝溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O |
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的小 | |
| B. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl,无沉淀析出 | |
| D. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 |
 50mL 0.55mol/L盐酸与50mL 0.50mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.55mol/L盐酸与50mL 0.50mol/LNaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题: