题目内容
12.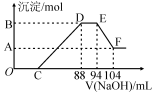 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入2mol.L-l的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入2mol.L-l的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )| A. | 反应前的溶液中,硝酸的物质的量为0.2 mol | |
| B. | C点对应NaOH溶液的体积为48 mL | |
| C. | 样品中铝粉和铁粉的物质的量之比为5:3 | |
| D. | D点与A点沉淀物质的量的差为0.02 mol |
分析 铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3•H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
B与A的差值为氢氧化铝的物质的量,计算EF段消耗的氢氧化钠,根据Al(OH)3 +OH-=AlO2-+2H2O,得出Al(OH)3的物质的量;
根据DE段消耗的氢氧化钠计算溶液中n(NH4+),结合Al(OH)3的物质的量,再根据电子转移守恒,计算Fe的物质的量;
由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,根据钠元素守恒计算硝酸钠,结合n(NH4+)可得n(NH4NO3),根据氮元素守恒可知:原硝酸溶液中n(HNO3)=n(NaNO3)+2n(NH4NO3),而C点溶液为NaNO3、NH4NO3、Fe(NO3)3、Al(NO3)3,根据氮元素守恒计算C点溶液中n′(NaNO3),进而计算NaOH溶液的体积,据此解答.
解答 解:铝粉和铁粉的混合物与一定量很稀HNO3充分反应,被氧化为Al3+、Fe3+,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由+5变成了-3价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与NH4+发生了反应,则随着NaOH的滴加,发生的反应依次有:
①H++OH-=H2O,②Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,③NH4++OH-═NH3•H2O,④Al(OH)3 +OH-=AlO2-+2H2O,
B与A的差值为氢氧化铝的物质的量,由图可知,EF段消耗的氢氧化钠溶液为:104mL-94m=10mL,故该阶段参加反应的氢氧化钠为:0.01L×2mol/L=0.02mol,根据Al(OH)3 +OH-=AlO2-+2H2O可知,Al(OH)3的物质的量为0.02mol,根据铝元素守恒,故混合金属中n(Al)=0.02mol,
由图可知DE段消耗的氢氧化钠的体积为:94mL-88mL=6mL,故该阶段参加反应的氢氧化钠为:0.006L×2mol/L=0.012mol,根据NH4++OH-═NH3•H2O 可知,计算溶液中n(NH4+)=0.012mL,根据电子转移守恒有:3n(Fe)+3n(Al)=8n(NH4+),即3n(Fe)+3×0.02mol=8×0.012mol,解得:n(Fe)=0.012mol,
由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,n(NH4NO3)=n(NH4+)=0.012mol,根据钠元素守恒,可知n(NaNO3)=n(NaOH)=0.088L×2mol/L=0.176mol,根据氮元素守恒计算原硝酸溶液中n(HNO3)=n(NaNO3)+2n(NH4NO3)=0.176mol+0.012mol×2=0.2mol,而c点溶液为NaNO3、NH4NO3、Fe(NO3)3、Al(NO3)3,根据氮元素守恒n′(NaNO3)+2n(NH4NO3)+3n[Fe(NO3)3]+3n[Al(NO3)3]=n(HNO3),故C点溶液中n′(NaNO3)=0.2mol-0.012mol×2-0.012mol×3-0.02mol×3=0.08mol,故C点加入NaOH的物质的量为0.08mol,
A.根反应前的溶液中,硝酸的物质的量为0.2 mol,故A正确;
B.根据分析可知,C点对应NaOH溶液的体积=$\frac{0.08mol}{2mol/L}$=0.04L=40mL,故B错误;
C.根据分析可知,混合金属中n(Al)=0.02mol、n(Fe)=0.012mol,样品中铝粉和铁粉的物质的量之比为5:3,故C正确;
D.D点与A点沉淀物质的量的差为氢氧化铝的物质的量,即为0.02 mol,故D正确;
故选B.
点评 本题以图象形式考查金属与硝酸的反应、混合物计算等,题目难度较大,明确图中各阶段反应过程是解题的关键,解答中注意守恒思想的运用,为易错题目,试题培养了学生的分析能力及化学计算能力.

| A. | 常温常压下,22.4 L CO2中含有NA个CO2分子 | |
| B. | 1.7 g H2O2中含有的电子数为0.9NA | |
| C. | 标准状况下,2.24 L乙醇含有的分子数等于0.1NA | |
| D. | 分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
①取20.0mL该溶液,加入25.0mL 4.00mol•L-1NaOH溶液,有白色沉淀、无剌激气味气体.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100mL,测得滤液中c(OHˉ)为0.20mol•L-1;
②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g.
由此可得出关于原溶液组成的正确结论是( )
| A. | 一定含有Mg2+、Al3+、Clˉ,可能含有Na+,不含NH4+ | |
| B. | 一定含有Mg2+、Clˉ,不含NH4+,可能含有Na+、Al3+ | |
| C. | c (Clˉ) 为 4.00 mol•L-1,c(Al3+)为5.00 mol•L-1 | |
| D. | c (Mg2+) 为 1.00 mol•L-1,c(Na+)为 0.5mol•L-1 |
磁流体是一种新型的功能材料,它像固体磁性材料一样具有磁性,却又保留了液体的性质,具有广泛的应用前景.例如在医学领域,一种相容性铁磁流体可被用于癌症检测;利用铁磁流体还可以摘除肿瘤,当铁磁流体被注入肿瘤体并被置于快速变化的磁场当中,它在肿瘤中运动产生摩擦热从而破坏肿瘤.
磁流体的分类方法较多,下面几种是比较常用的方法.按照磁性粒子种类,磁流体可分为:铁氧体类磁流体,其磁性粒子是Fe3O4、MeFe2O4(Me=Co,Mn,Ni)等;金属类磁流体,其磁性粒子是Co、Fe、Ni及其合金;氮化铁类磁流体,其磁性粒子是氮化铁.按照应用领域,磁流体可分为:密封用磁流体、医疗用磁流体、润滑用磁流体、印刷打印用磁流体、能量转换用磁流体等.按照性能指标,磁流体可分为:高粘度磁流体和低粘度磁流体、高挥发损失磁流体和低挥发损失磁流体、高饱和磁化度磁流体和低饱和磁化度磁流体、重磁流体和轻磁流体.
磁流体有不同的制备方法(如表所示)
| 制备方法 | 化学共沉淀法 | 碾磨法 | 蒸着(zhuó)法 |
| 制得磁流体颗粒直径 | 大约40纳米左右 | 大于300纳米 | 2-10纳米 |
(1)磁流体可以按照磁性粒子种类分类,还可以按照应用领域和性能指标进行分类.
(2)能制得属于胶体的磁流体的方法是化学共沉淀法、蒸着法.
(3)化学共沉淀法制磁流体的反应为Fe2++2Fe3++8OH-=Fe3O4+ H2O,将制得的磁流体用滤纸过滤,滤液呈黑色,其原因是胶体的分散质能通过滤纸孔隙.
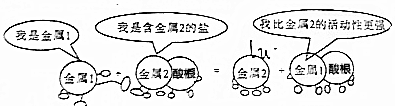
| A. | 此反应不可能是复分解反应 | |
| B. | 若金属1是锌,金属2可能是银 | |
| C. | 还原性:金属1>金属2 | |
| D. | 若金属2为铜,则反应过程中生成2mol金属2,转移的电子数为2NA |
