题目内容
1.某混合物A含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现如图所示变化.
请回答下列问题.
(1)C、D、G、H 4种物质的化学式为:CFe2O3、DKAlO2、GKAl(SO4)2、H(NH4)2SO4.
(2)沉淀F与KOH溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O沉淀E加热生成B的化学方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O溶液G与过量稀氨水反应的化学方程式为Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4.
分析 A含有Al2(SO4)3、Al2O3和Fe2O3,由Al2(SO4)3溶于水,Al2O3和Fe2O3均不溶于水,结合流程可知,混合物A加水溶解后,溶液G为KAl(SO4)2,沉淀F为Al2O3和Fe2O3;由转化关系图可知,向沉淀F中加KOH溶液,Fe2O3不反应,沉淀C为Fe2O3,Al2O3可与KOH溶液反应生成D为KAlO2,向KAlO2溶液中加入适量盐酸,可得E为Al(OH)3沉淀,Al(OH)3受热分解生成固体B为Al2O3;向溶液G中加过量氨水,溶液与过量氨水反应,Al3+被沉淀,得到氢氧化铝沉淀,溶液中H为(NH4)2SO4,然后结合物质的性质及化学用语来解答.
解答 解:(1)由上述分析可知,C为Fe2O3,D为KAlO2,G为KAl(SO4)2,H为(NH4)2SO4,
故答案为:Fe2O3;KAlO2;KAl(SO4)2;(NH4)2SO4;
(2)沉淀F与KOH溶液反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O;
沉淀E加热生成B的化学方程式为2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;
溶液G与过量稀氨水反应的化学方程式为Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4,
故答案为:Al2O3+2OH-=2AlO2-+H2O;2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O;Al2(SO4)3+6NH3•H2O=2Al(OH)3↓+3(NH4)2SO4.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、流程中发生的反应为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

| A. | 300 mL、1mol•L-1NaCl溶液 | B. | 75 mL、2mol•L-1CaCl2溶液 | ||
| C. | 150 mL、2mol•L-1KCl溶液 | D. | 75 mL、1mol•L-1AlCl3溶液 |
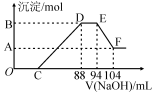 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入2mol.L-l的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.现有一定量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入2mol.L-l的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )| A. | 反应前的溶液中,硝酸的物质的量为0.2 mol | |
| B. | C点对应NaOH溶液的体积为48 mL | |
| C. | 样品中铝粉和铁粉的物质的量之比为5:3 | |
| D. | D点与A点沉淀物质的量的差为0.02 mol |
| A. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、Cl-、CO32- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- | |
| C. | 0.1 mol/L的NaNO3溶液中:H+、Fe2+、Cl-、SO42- | |
| D. | 含有大量Al3+的水溶液中:Na+、NH4+、HCO3-、Br- |
| A. | Al2O3可用作耐火材料,用小苏打发酵面团制作馒头 | |
| B. | 碳素钢的熔点比纯铁低、司母戊鼎的主要成分是铜合金 | |
| C. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水剂明矾可以使海水淡化 | |
| D. | 绚丽缤纷的烟花中添加了含钾,钙,钠,铜等金属元素化合物 |
| A. | CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ•mol-1(燃烧热) | |
| B. | 同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 已知:2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2;则△H1<△H2 |
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Fe2+、NO3-、SO42- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Na+、K+、ClO-、NO3- |
 脂肪酸
脂肪酸 )。
)。 ”标志垃圾筒的是 (填字母)。
”标志垃圾筒的是 (填字母)。