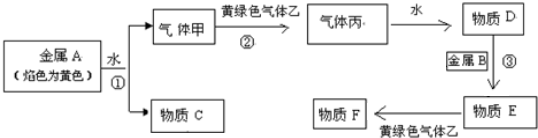
题目内容
20.相同状况下,等物质的量的Na、Mg、Al、Zn分别与足量的稀硫酸反应,生成氢气的体积比为1:2:3:2.分析 设各金属的物质的量为1mol,完全反应时失去电子的物质的量分别为1mol、2mol、3mol、2mol,然后根据电子守恒计算出生成氢气的物质的量之比,相同条件下气体的体积之比等于物质的量之比.
解答 解:相同状况下,生成氢气体积之比等于其物质的量之比,
假设Na、Mg、Al、Zn的物质的量都是1mol,完全反应时失去电子的物质的量分别为1mol、2mol、3mol、2mol,
根据氧化还原反应中转移电子相等可知,生成氢气的物质的量之比为:$\frac{1mol}{2}$:$\frac{2mol}{2}$:$\frac{3mol}{2}$:$\frac{2mol}{2}$=1:2:3:2,
故答案为:1:2:3:2.
点评 本题考查了金属与酸的化学计算,题目难度不大,明确常见金属与酸反应的实质为解答关键,注意掌握电子守恒在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目