题目内容
10.硝酸生产中,500℃时,NH3和O2可能发生如下反应:①4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g)△H=-9072kJ•mol-1?K=1.1×1026?
②4ΝΗ3 (g)+4O2 (g)?2N2O (g)+6H2O (g)△H=-1104.9kJ•mol-1?K=4.4×1028
③4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g)△H=-1269.02kJ•mol-1?K=7.1×1034
其中,②、③是副反应.若要减少副反应,提高NO的产率,最合理的措施是( )
| A. | 减小压强 | B. | 降低温度 | ||
| C. | 增大O2浓度 | D. | 使用合适的催化剂 |
分析 由反应可知主反应与副反应均为放热反应,反应进行的程度很大,根据压强、温度、催化剂对速率的影响,以及产物NO的性质分析.
解答 解:A、减小压强,反应速率减小,副反应③生成氮气增多,NO的产率减小,故A错误;
B、降低温度,反应速率减小,NO的产率减小,故B错误;
C、增大O2浓度,氧气过量时与NO反应生成NO2,则NO的产率减小,故C错误;
D、使用合适的催化剂,能增大反应速率,提高NO的产率,故D正确;
故选D.
点评 本题考查了工业生产条件的选择,侧重于压强、温度、催化剂对速率的影响的考查,题目难度不大.

练习册系列答案
相关题目
18.能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的
开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g),
如表所列数据是该反应在不同温度下的化学平衡常数(K).
①对于气相反应,用某组分(B)的平衡压强( PB)代替物质的量浓度( cB)也可表示平衡常数(记作KP),写出该反应的平衡常数表达式KP=$\frac{P(C{H}_{3}OH)}{P(C{O}_{2})×{P}^{2}({H}_{2})}$.
②下列措施可以加快反应速率且能提高CO 转化率的是c.
a.再充入CO b.将甲醇液化并及时分离出 c.增大压强d.加入催化剂e.降低温度
③在300℃时,将2mol CO、3mol H2 和2mol CH3OH 充入容积为1L 的密闭容器中,此时反应将向正反应方向进行(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
( 2 ) 以甲醇、氧气为原料,KOH 溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO${\;}_{3}^{2-}$+6H2O,则负极的电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,随着反应的不断进行溶液的pH减小 (填“增大”“减小”或“不变”).
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:2Cl--2e-=Cl2↑;如果电解一段时间后NaCl 溶液的体积为1L,溶液的pH 为12(25℃下测定),则理论上消耗氧气的体积为56 mL(标况下).
开发和应用前景.
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)?CH3OH(g),
如表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②下列措施可以加快反应速率且能提高CO 转化率的是c.
a.再充入CO b.将甲醇液化并及时分离出 c.增大压强d.加入催化剂e.降低温度
③在300℃时,将2mol CO、3mol H2 和2mol CH3OH 充入容积为1L 的密闭容器中,此时反应将向正反应方向进行(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”).
( 2 ) 以甲醇、氧气为原料,KOH 溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO${\;}_{3}^{2-}$+6H2O,则负极的电极反应式为:CH3OH+8OH--6e-=CO32-+6H2O,随着反应的不断进行溶液的pH减小 (填“增大”“减小”或“不变”).
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:2Cl--2e-=Cl2↑;如果电解一段时间后NaCl 溶液的体积为1L,溶液的pH 为12(25℃下测定),则理论上消耗氧气的体积为56 mL(标况下).
5.在一个恒容密闭容器中盛有22g气体X (X的摩尔质量为44g•mol-1),容器内压强2×104Pa.若在相同温度下继续把气体X充入容器,使容器内压强增大到5×104Pa,则这时容器内气体X的分子数约为:(注:恒温恒容下,气体的压强之比等于气体的分子数之比)( )
| A. | 3.3×1023 | B. | 3.3×1024 | C. | 7.5×1023 | D. | 7.5×1022 |
2.向27.2Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2.在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g.下列说法正确的是( )
| A. | Cu与Cu2O 的物质的量之比为1:2 | |
| B. | 产生的NO的体积为4.48L | |
| C. | 硝酸的物质的量浓度为2.6mol/L | |
| D. | Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
20.下列有关设计的方案能达到实验目的是( )
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液,有气体生成,溶液未呈血红色,说明稀硝酸不能将Fe氧化为Fe3+ | |
| B. | 除去FeCl3溶液中少量Cu2+:向含有少量Cu2+的FeCl3溶液中加入适量铁粉,充分反应后过滤 | |
| C. | 比较Fe(OH)3和Al(OH)3的Ksp:向0.1mol•L-1的FeCl3溶液中滴加0.1mol•L-1氨水至不再产生沉淀,然后再滴入0.1mol•L-1A1Cl3溶液,观察现象 | |
| D. | 验证氧化性Fe3+<Br2<Cl2;向试管中依次加入1mL0.1mol•L-1FeBr2溶液、几滴KSCN溶液和1mL苯,然后逐滴加入氯水,并缓缓振荡,直到氯水过量,观察整个过程中有机层和水层中的现象. |
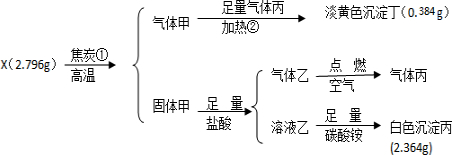
 .
.