题目内容
15.不能说明醋酸是弱电解质的是( )| A. | 醋酸溶液导电性差 | B. | 醋酸溶液中存在醋酸分子 | ||
| C. | 醋酸钠溶液呈碱性 | D. | 0.1 mol/L醋酸溶液的pH=2.9 |
分析 要证明醋酸为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答 解:A.导电能力强弱与离子浓度大小有关,与电解质的强弱无关,故A选;
B.醋酸溶液中存在醋酸分子,说明醋酸部分电离,能说明醋酸是弱电解质,故B不选;
C.醋酸钠溶液呈碱性,说明醋酸根离子发生了水解,则醋酸为弱酸,能说明醋酸是弱电解质,故C不选;
D.0.1 mol/L醋酸溶液的pH=2.9,说明醋酸部分电离,能说明醋酸是弱电解质,故D不选;
故选A.
点评 本题考查了弱电解质的判断,题目难度不大,电解质强弱是根据其电离程度划分的,不能根据溶液导电性强弱划分,为易错点.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
5.下列化合物,苯环上的氢原子被澳原子取代,所得一溴代物有三种同分异构体的是( )

| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
6.已知反应:3C12+NH3→6NH4Cl+N2,下列分析正确的是(设阿伏伽德罗常数为NA)( )
| A. | 若3molC12反应,得到氧化产物6mol | |
| B. | 若常温下生成22.4LN2,转移电子数6NA | |
| C. | 若转移6mol电子,被氧化的NH3是8mol | |
| D. | 若生成1 molNH4Cl转移电子n个,则NA=n |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.8g铁粉与50mL 4mol/L盐酸反应转移电子的数目为0.15NA | |
| B. | 常温下1 L pH=13的氢氧化钠溶液中由水电离出的H+的数目为0.1NA | |
| C. | 标准状况下,8.96L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.2NA | |
| D. | 1mol苯中所含碳碳双键的数目为3NA |
10.将Na、Na2O、NaHSO4、干冰、Si分别加热熔化,需要克服的作用力有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
20.如图是模拟铁的电化学防护装置,不正确的叙述是( )
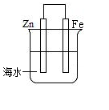

| A. | 此装置属于原电池 | |
| B. | 此装置中电子从铁经导线流向锌 | |
| C. | 此装置中的铁极上发生还原反应 | |
| D. | 该电化学防护法称为“牺牲阳极阴极保护法” |
7.下列现象与氧化还原反应无关的是( )
| A. | 钢铁生锈 | B. | 食物变质 | C. | 溶洞形成 | D. | 氯气消毒 |
4.用CO2、CO合成甲醇是碳减排的新方向,其发生的化学方程式如下:CO2+3H2?CH3OH+H2O;CO+2H2?CH3OH,若CO2和CO混合气共消耗H2 10mol,生成甲醇4mol,则参加反应的CO2是( )
| A. | 1 mol | B. | 2 mol | C. | 3 mol | D. | 4 mol |
5.下列仪器可以直接加热的是( )
| A. | 烧杯 | B. | 容量瓶 | C. | 蒸馏烧瓶 | D. | 试管 |