题目内容
6.已知反应:3C12+NH3→6NH4Cl+N2,下列分析正确的是(设阿伏伽德罗常数为NA)( )| A. | 若3molC12反应,得到氧化产物6mol | |
| B. | 若常温下生成22.4LN2,转移电子数6NA | |
| C. | 若转移6mol电子,被氧化的NH3是8mol | |
| D. | 若生成1 molNH4Cl转移电子n个,则NA=n |
分析 根据反应3C12+8NH3=6NH4Cl+N2可知:此反应中3mol氯气做氧化剂,被还原为6molNH4Cl,得6mol电子;而8molNH3中有2mol氨气做还原剂,被氧化为1mol氮气,此过程中失去6mol电子,即此反应转移6mol电子,据此分析.
解答 解:根据反应3C12+8NH3=6NH4Cl+N2可知:此反应中3mol氯气做氧化剂,被还原为6molNH4Cl,得6mol电子;而8molNH3中有2mol氨气做还原剂,被氧化为1mol氮气,此过程中失去6mol电子,即此反应转移6mol电子.
A、氯气做氧化剂,被还原,故得到的是还原产物,故A错误;
B、在常温下,气体摩尔体积大于22.4L,故生成的22.4L氮气的物质的量小于1mol,则转移的电子书小于6NA个,故B错误;
C、当转移6mol电子时,参与反应的氨气为8mol,但其中被氧化的是2mol,故C错误;
D、此反应生成6mol氯化铵,转移6mol电子,故当生成1mol氯化铵时转移1mol电子即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意公式的运用和物质的结构特点.

练习册系列答案
相关题目
13.下列说法不正确的是( )
| A. | 在常温下SiO2(s)+2C(s)=Si(s)+2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 常温下,NH4Cl溶液加水稀释$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$不变 | |
| C. | 向硅酸钠溶液中滴加酚酞,溶液变红,证明了Na2SiO3发生了水解 | |
| D. | 如图可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化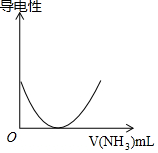 |
14.黄酒在存放过程中,有部分乙醇转化为乙酸,导致黄酒变酸.该过程中发生的反应为( )
| A. | 取代反应 | B. | 加成反应 | C. | 氧化反应 | D. | 酯化反应 |
1.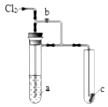 将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )
将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )
 将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )
将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )| A. | 浓FeCl2溶液 | B. | 饱和KI溶液 | C. | 饱和食盐水 | D. | 浓NaOH溶液 |
18.下列关于实验操作的叙述正确的是( )
| A. | 酸碱滴定时,眼睛一定要注视滴定管中液面的变化 | |
| B. | 实验室制乙烯时,为使受热均匀,应轻轻搅动温度计 | |
| C. | 测溶液酸碱性时,须将PH试纸浸入待测液中 | |
| D. | 分液时,下层液体先从分液漏斗下口放出,上层液体后从上口倒出 |
15.不能说明醋酸是弱电解质的是( )
| A. | 醋酸溶液导电性差 | B. | 醋酸溶液中存在醋酸分子 | ||
| C. | 醋酸钠溶液呈碱性 | D. | 0.1 mol/L醋酸溶液的pH=2.9 |
16.下列反应中,水作还原剂的反应是( )
| A. | CaO+H2O→Ca(OH)2 | B. | 2Na+2H2O→2NaOH+H2↑ | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2H2+O2$\stackrel{点燃}{→}$2H2O |
