题目内容
10.将Na、Na2O、NaHSO4、干冰、Si分别加热熔化,需要克服的作用力有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 Na、Na2O、NaHSO4、干冰、Si中Na为金属晶体,Na2O、NaHSO4为离子晶体,干冰为分子晶体、Si为原子晶体,以此解答.
解答 解:Na为金属晶体,熔化时克服金属键,Na2O、NaHSO4为离子晶体,熔化时克服离子键,干冰为分子晶体熔化克服分子间作用力,Si为原子晶体熔化克服共价键,所以需要克服的作用力有4种.
故选C.
点评 本题考查晶体类型的判断和化学键键的判断,侧重于学生的分析能力和基本概念的考查,题目难度不大,注意晶体类型的分类和性质的区别.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
17.下列实验操作及现象能够达到对应实验目的是( )
| 实验操作及现象 | 实验目的 | |
| A | 将SO2通入品红溶液中,品红溶液褪色;加热褪色后的品红溶液,溶液恢复红色 | 证明亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下KSP(BaCO3)>KSP(BaSO4) |
| C | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
| A. | A | B. | B | C. | C | D. | D |
1.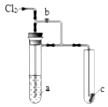 将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )
将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )
 将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )
将氯气通入如图装置.若打开活塞,则小试管里的干燥品红试纸c不褪色;若关闭活塞b,c很快褪色.则a溶液可能是( )| A. | 浓FeCl2溶液 | B. | 饱和KI溶液 | C. | 饱和食盐水 | D. | 浓NaOH溶液 |
18.下列关于实验操作的叙述正确的是( )
| A. | 酸碱滴定时,眼睛一定要注视滴定管中液面的变化 | |
| B. | 实验室制乙烯时,为使受热均匀,应轻轻搅动温度计 | |
| C. | 测溶液酸碱性时,须将PH试纸浸入待测液中 | |
| D. | 分液时,下层液体先从分液漏斗下口放出,上层液体后从上口倒出 |
5.工业上生产乙烯、丙烯的主要方法是( )
| A. | 裂化 | B. | 干馏 | C. | 分馏 | D. | 裂解 |
15.不能说明醋酸是弱电解质的是( )
| A. | 醋酸溶液导电性差 | B. | 醋酸溶液中存在醋酸分子 | ||
| C. | 醋酸钠溶液呈碱性 | D. | 0.1 mol/L醋酸溶液的pH=2.9 |
2.120mL含有0.20mol碳酸钠的溶液和200mL1.5mol/L盐酸,①将前者滴加入后者,②将后者滴加入前者.不合理的描述是( )
| A. | 都有气体产生 | B. | 最终产生的气体体积相同 | ||
| C. | ①中一开始就产生气体 | D. | ②中一开始不产生气体 |
19.下列工业生产的条件选择与勒沙特列原理无关的是( )
| A. | 工业合成氯化氢时使用过量氢气 | |
| B. | 硫酸工业接触室中使用过量空气 | |
| C. | 合成氨工业采用20~50 MPa高压 | |
| D. | 侯氏制碱法向母液中加入氯化钠提取氯化铵 |
20.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 标准状况下,22.4 L CH4含有的共价键数为NA | |
| B. | 1 mol Fe与1mol Cl2充分反应,电子转移数为3NA | |
| C. | 常温下,pH=2的醋酸溶液中含有的H+数目为0.02NA | |
| D. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |