题目内容
17.下列说法正确的是( )| A. | 置换反应一定属于氧化还原反应 | B. | 分解反应均不属于氧化还原反应 | ||
| C. | 复分解反应有的属于氧化还原反应 | D. | 化合反应有的属于氧化还原反应 |
分析 有化合价变化的反应是氧化还原反应,据此分析.
解答 解:A.置换反应中反应物中和生成物中各一种单质和一种化合物,但形成单质的元素不同,因此这两种元素的化合价一定发生了变化,属于氧化还原反应,故A正确
B.分解反应中可能存在化合价的变化,如氯酸钾分解生成氧气,属于氧化还原反应,故B错误;
C.复分解反应中没有元素化合价的变化,不属于氧化还原反应,故C错误;
D.化合反应中有多种反应物,一种生成物(化合物),则只要反应物中存在单质,就一定是氧化还原反应,都是化合物且元素化合价都没有变,则是非氧化还原反应,故D正确.
故选:AD.
点评 本题考查学生氧化还原反应和四大基本反应类型之间的关系知识,注意把握氧化还原反应的特征及判断方法,较简单.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
8.下列属于分子晶体的一组物质是( )
| A. | CaO、NO、CO | B. | CCl4、H2O2、He | C. | CO2、SO2、NaCl | D. | CH4、O2、Na2O |
5.实室用空气和下列药品、仪器装置制取少量氮化镁.
(1)如果所制气体从左向右流向时,各个装置中导管连接的正确顺序是H接F、E接D、C接M、N接A.
(2)实验开始时,应先在(填字母)G处接通自来水管,然后再依次点燃装有Cu粉装置酒精灯和装有Mg粉装置的酒精灯.
(3)浓H2SO4的作用除去空气中的水,饱和Na0H溶液发生反应的离子方程式:CO2+2OH-=H2O+CO32-.
(4)装置5中发生反应的化学方程式2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
(5)装置1中发生反应的化学方程式:3Mg+N2$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2.
(6)若空气中的氧未除尽,则制取的Mg3N2中一定含有氧化镁.
(7)氮化镁能与水反应生成Mg(OH)2和NH3,若取含有MgO的Mg3N2的混合物2.5g,恰好与370毫升0.5摩/升的盐酸完全反应,该混合物中MgO的质量分数为20%.
| 序号 | 1 | 2 | 3 | 4 | 5 |
| 仪器及装置 |  |  |  |  |  |
(2)实验开始时,应先在(填字母)G处接通自来水管,然后再依次点燃装有Cu粉装置酒精灯和装有Mg粉装置的酒精灯.
(3)浓H2SO4的作用除去空气中的水,饱和Na0H溶液发生反应的离子方程式:CO2+2OH-=H2O+CO32-.
(4)装置5中发生反应的化学方程式2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
(5)装置1中发生反应的化学方程式:3Mg+N2$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2.
(6)若空气中的氧未除尽,则制取的Mg3N2中一定含有氧化镁.
(7)氮化镁能与水反应生成Mg(OH)2和NH3,若取含有MgO的Mg3N2的混合物2.5g,恰好与370毫升0.5摩/升的盐酸完全反应,该混合物中MgO的质量分数为20%.
12.下列说法不正确的是( )
①做一次中和热的测定,至少需要使用两次温度计.
②化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体.
③铝热反应属于放热反应.
④同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同.
①做一次中和热的测定,至少需要使用两次温度计.
②化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体.
③铝热反应属于放热反应.
④同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同.
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ③④ |
6.如图各坐标中Z为第三周期元素的核电荷数,Y表示相应元素的有关性质,其中曲线描述与元素有关性质相符的选项是( )
| A. |  Y表示原子半径 | B. |  Y表示元素的电负性 | ||
| C. | 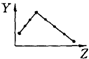 Y表示元素的最高正价 | D. |  Y表示元素的第一电离能 |
7.下列反应的离子方程式错误的是( )
| A. | 向碳酸氢钙溶液中加入过量氢氧化钠Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 金属铝溶于盐酸中:Al+2H+═Al3++H2↑ | |
| C. | 氢氧化铝与足量盐酸反应Al(OH)3+3H+═Al3++3H2O | |
| D. | 少量CO2通入氢氧化钠溶液中CO2+2OH-═CO32-+H2O |