题目内容
5.实室用空气和下列药品、仪器装置制取少量氮化镁.| 序号 | 1 | 2 | 3 | 4 | 5 |
| 仪器及装置 |  |  | 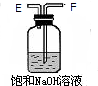 | 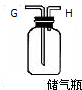 |  |
(2)实验开始时,应先在(填字母)G处接通自来水管,然后再依次点燃装有Cu粉装置酒精灯和装有Mg粉装置的酒精灯.
(3)浓H2SO4的作用除去空气中的水,饱和Na0H溶液发生反应的离子方程式:CO2+2OH-=H2O+CO32-.
(4)装置5中发生反应的化学方程式2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
(5)装置1中发生反应的化学方程式:3Mg+N2$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2.
(6)若空气中的氧未除尽,则制取的Mg3N2中一定含有氧化镁.
(7)氮化镁能与水反应生成Mg(OH)2和NH3,若取含有MgO的Mg3N2的混合物2.5g,恰好与370毫升0.5摩/升的盐酸完全反应,该混合物中MgO的质量分数为20%.
分析 (1)根据题中提供的药品和装置可知,该实验是用空气中氮气和镁在加热条件下生成氮化镁,空气中有二氧化碳和氧气、水蒸汽,都能与镁反应,所以在氮气与镁反应之前必须将这些杂质除去,据此答题;
(2)实验开始时,应先在装置中能一会儿空气,将原装置中的空气排尽,然后再将通进去的空气中氧气除尽,再在镁粉处加热产生氮化镁;
(3)浓H2SO4具有吸水性;饱和Na0H溶液用来吸收空气中二氧化碳;
(4)装置5中用加热的铜粉除去空气中的氧气;
(5)装置1中发生的反应是氮气与镁粉在加热的条件下产生氮化镁;
(6)若空气中的氧未除尽,则镁会与氧气反应生成氧化镁;
(7)MgO的Mg3N2的混合物与盐酸反应的方程式为MgO+2HCl=MgCl2+H2O、Mg3N2+8HCl=3MgCl2+2NH4Cl,根据两个方程式列方程组可以求得混合物中MgO的质量,进而确定MgO的质量分数;
解答 解:(1)根据题中提供的药品和装置可知,该实验是用空气中氮气和镁在加热条件下生成氮化镁,空气中有二氧化碳和氧气、水蒸汽,都能与镁反应,所以在氮气与镁反应之前必须将这些杂质除去,先用氢氧化钠溶液除去二氧化碳,后用浓硫酸除去水,再用灼热的铜除去氧气,再用氮气与镁反应,所以各个装置中导管连接的正确顺序是H接F、E接D、C接M、N接A,
故答案为:H接F、E接D、C接M、N接A;
(2)实验开始时,应先在装置中能一会儿空气,将原装置中的空气排尽,然后再将通进去的空气中氧气除尽,再在镁粉处加热产生氮化镁,所以应先在G处接通自来水管,然后再依次点燃装有Cu 粉装置酒精灯和装有Mg 粉装置的酒精灯,
故答案为:G;Cu;Mg;
(3)浓H2SO4具有吸水性,浓H2SO4的作用是除去空气中的水,饱和Na0H溶液用来吸收空气中二氧化碳,反应的离子方程式为CO2+2OH-=H2O+CO32-,
故答案为:除去空气中的水;CO2+2OH-=H2O+CO32-;
(4)装置5中用加热的铜粉除去空气中的氧气,反应的化学方程式为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,
故答案为:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;
(5)装置1中发生的反应是氮气与镁粉在加热的条件下产生氮化镁,反应的化学方程式为3Mg+N2$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2,
故答案为:3Mg+N2$\frac{\underline{\;\;△\;\;}}{\;}$Mg3N2;
(6)若空气中的氧未除尽,则镁会与氧气反应生成氧化镁,
故答案为:氧化镁;
(7)设MgO的Mg3N2的混合物中MgO为x,Mg3N2为yg,370毫升0.5摩/升的盐酸含氯化氢的物质的量为0.185mol,根据反应MgO+2HCl=MgCl2+H2O和反应Mg3N2+8HCl=3MgCl2+2NH4Cl有$\left\{\begin{array}{l}{x+y=2.5}\\{\frac{x}{40}×2+\frac{y}{100}×8=0.185}\end{array}\right.$,所以x=0.5,y=2,所以MgO的质量分数为$\frac{0.5}{2.5}$×100%=20%,
故答案为:20%.
点评 本题为综合题,主要考查了金属镁的性质,题目难度中等,氮化镁制备的实验分析是难点,注意把握反应的实质和各个仪器的用途是解题的关键

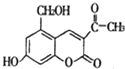 某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图所示.关于“亮菌甲素”的说法中,正确的是( )
某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式如图所示.关于“亮菌甲素”的说法中,正确的是( )| A. | “亮菌甲素”的分子式为C12H12O5 | |
| B. | “亮菌甲素”可以与乙酸发生酯化反应 | |
| C. | 1 mol“亮菌甲素”最多能和2 mol NaOH反应 | |
| D. | 1 mol“亮菌甲素”最多能和4 mol H2发生加成反应 |
| A. | A沸点比B低 | |
| B. | 若A、B均为气体,则A比B易液化 | |
| C. | A相对密度比B小 | |
| D. | 已知A在常温下为液态,则B不可能为气态 |
| A. | 淀粉 | B. | 油脂 | C. | 聚乙烯 | D. | 硝酸纤维 |
| A. | 置换反应一定属于氧化还原反应 | B. | 分解反应均不属于氧化还原反应 | ||
| C. | 复分解反应有的属于氧化还原反应 | D. | 化合反应有的属于氧化还原反应 |
| A. | 1moLAl3+离子含有的电子数为3NA | |
| B. | 1moLCl2含有1NA个原子 | |
| C. | 78g过氧化钠固体中,含有1NA个阴离子 | |
| D. | 欲配制1.00L1.00mol•L-1的NaCl溶液,可将58.5gNaCl溶于1.00L 水中 |