题目内容
2.6.4g铜与足量的18mol∕L浓硝酸发生反应.(小数点后保留两位数字)(1)被还原的浓硝酸为多少升?
(2)生成的气体为多少克?
分析 发生反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,根据方程式计算生成NO2的物质的量,被还原的硝酸生成NO2,根据N原子守恒计算被还原硝酸的物质的量,再根据c=$\frac{n}{c}$计算消耗浓硝酸的体积;根据m=nM计算生成二氧化氮的质量.
解答 解:6.4g Cu的物质的量为$\frac{6.4g}{64g/mol}$=0.1mol,
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
0.1mol 0.2mol
被还原的硝酸生成NO2,根据N原子守恒,被还原硝酸的物质的量为0.2mol,则消耗浓硝酸的体积为$\frac{0.2mol}{18g/mol}$≈0.01L;
生成气体的质量为0.02mol×46g/mol=0.92g
答:(1)被还原的浓硝酸为0.01L;
(2)生成的气体为0.92克.
点评 本题考查氧化还原反应的有关计算,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
10.下列物质属于天然高分子化合物的是( )
| A. | 淀粉 | B. | 油脂 | C. | 聚乙烯 | D. | 硝酸纤维 |
17.下列说法正确的是( )
| A. | 置换反应一定属于氧化还原反应 | B. | 分解反应均不属于氧化还原反应 | ||
| C. | 复分解反应有的属于氧化还原反应 | D. | 化合反应有的属于氧化还原反应 |
11.用下列试剂或方法不能别NaOH溶液和KCl溶液的是( )
| A. | 紫色石蕊试液 | B. | Ba(N03)2溶液 | C. | CuCl2溶液 | D. | 焰色反应 |
12.下列解释实验事实的方程式不正确的是( )
| A. | Mg(OH)2悬浊液中滴加浓的NH4Cl溶液,沉淀溶解:Mg(OH)2+2H+═2H2O+Mg2+ | |
| B. | “NO2球”浸泡在冷水中,颜色变浅2NO2 (红棕色,g)?N2O4(无色,g)△H<0 | |
| C. | 铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | 将饱和FeCl3溶液滴入沸水并煮沸至红褐色:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ |
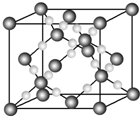 A、B、C、D、E、F为原子序数依次增大的短周期主族元素.A、C、D可形成常见的气态单质,A、E最外层电子数与其电子层数相等.B、F同主族,B元素基态原子核外电子平均分布在3个不同的能级上.C元素原子的最高能级上有3个未成对电子.F的一种单质与FD2晶体类型相同.
A、B、C、D、E、F为原子序数依次增大的短周期主族元素.A、C、D可形成常见的气态单质,A、E最外层电子数与其电子层数相等.B、F同主族,B元素基态原子核外电子平均分布在3个不同的能级上.C元素原子的最高能级上有3个未成对电子.F的一种单质与FD2晶体类型相同.