题目内容
1.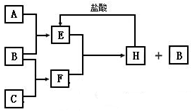 A、B、C是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):
A、B、C是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分.F的焰色反应呈黄色.在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):请填写下列空白:
(1)A是碳(或C),C是钠(或Na).
(2)H与盐酸反应生成E的化学方程式是Na2CO3+2HCl═2NaCl+H2O+CO2↑.
(3)E与F反应的化学方程式是2CO2+2Na2O2═2Na2CO3+O2.
分析 A、B、C是按原子序数由小到大排列的第二、三周期元素的单质.B、E均为组成空气的成分,单质B与C反应得到F,F的焰色反应呈黄色,说明F是钠的化合物,故C为Na,考虑B为O2,E是CO2,则F为Na2O2,H是Na2CO3,A为碳,以此解答该题.
解答 解:(1)由以上分析可知A为碳(或C),C为钠(或Na),故答案为:碳(或C);钠(或Na);
(2)H为碳酸钠,与盐酸反应生成氯化钠、水、二氧化碳,方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑,故答案为:Na2CO3+2HCl═2NaCl+H2O+CO2↑;
(3)二氧化碳和过氧化钠反应生成碳酸钠和氧气,方程式为2CO2+2Na2O2═2Na2CO3+O2,故答案为:2CO2+2Na2O2═2Na2CO3+O2.
点评 本题考查无机物的推断,为高考常见题型,注意充分利用焰色反应及第二、三周期常见元素单质进行推断,需要学生熟练掌握元素化合物知识,具备一定的推理能力,难度较大

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.自然界中含量最多的金属元素和非金属元素形成的稳定化合物是( )
| A. | Al2O3 | B. | SiO2 | C. | Fe2O2 | D. | CaO |
9.能正确表示下列反应的离子方程式是( )
| A. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 铝和氢氧化钠水溶液反应:Al+2OH-+2H2O═AlO2-+3H2↑ | |
| C. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH- $\frac{\underline{\;△\;}}{\;}$NH3↑+H2O | |
| D. | AlCl3溶液中滴加足量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
16.有一真空瓶质量为 m1,该瓶充入空气后质量为 m2.在相同状况下,若改为充入某气体 A 时,总质量为 m3.则 A 的相对分子质量是( )
| A. | 29$\frac{{m}_{2}}{{m}_{1}}$ | B. | 29$\frac{{m}_{3}}{{m}_{1}}$ | ||
| C. | 29$\frac{{m}_{3}-{m}_{1}}{{m}_{2}-{m}_{1}}$ | D. | 29$\frac{{m}_{2}-{m}_{1}}{{m}_{3}-{m}_{1}}$ |
13.有关晶体的下列说法中正确的是( )
| A. | 晶体中分子间作用力越大,分子越稳定 | |
| B. | 原子晶体中共价键越强,熔点越高 | |
| C. | 冰融化时水分子中共价键发生断裂 | |
| D. | 氢氧化钠熔化时离子键、共价键均被破坏 |
10.根据金属活动性顺序表,Cu不能发生:Cu+2H2O═Cu(OH)2+H2↑的反应,但选择恰当的电极材料和电解质溶液进行电解,这个反应就能实现.下列四组电极和电解质溶液中,能实现该反应最为恰当的一组是( )
| A | B | C | D | |
| 阳极 | 石墨棒 | Cu | Cu | Cu |
| 阴极 | 石墨棒 | 石墨棒 | Fe | Pt |
| 电解质 溶液 | CuSO4 溶液 | Na2SO4 溶液 | H2SO4 溶液 | CuSO4 溶液 |
| A. | A | B. | B | C. | C | D. | D |
11.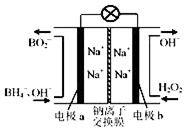 以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
 以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )
以硼氢化合物NaBH4(强电解质,B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法正确的是( )| A. | 电极a采用MnO2,MnO2既作电极材料又有催化作用 | |
| B. | 电池放电时Na+从b极区移向a极区 | |
| C. | 每消耗3mol H2O2,转移的电子为3mol | |
| D. | 该电池的负极反应为:BH4-+8OH--8e-═BO2-+6H2O |
 ;
;