题目内容
12.用下列实验装置进行相应实验,能达到实验目的是( )
| A. | 用图1所示装置,制备并收集少量NO2气体 | |
| B. | 用图2所示装置,除去CO2中的HCl | |
| C. | 装置3向左推动针筒活塞可检验该装置的气密性 | |
| D. | 用图4所示装置,所示装置制取并收集干燥纯净的NH3 |
分析 A.二氧化氮能与水反应生成一氧化氮;
B.Na2CO3溶液能够与二氧化碳反应;
C.根据液面是否发生变化判断;
D.氨气密度小于空气密度,应选择向下排气法.
解答 解:A.二氧化氮能与水反应生成一氧化氮,不能用排水法收集,故A错误;
B.Na2CO3溶液能够与二氧化碳反应,将原物质除掉,故B错误;
C.如不漏气,向左推动针筒活塞,可观察到液面发生变化,可用于检查是否漏气,故C正确;
D.氨气密度小于空气密度,应选择向下排气法,A中采用的是向上排气法,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及气体的制备、收集以及物质的分离、提纯等,把握反应原理、物质性质及实验装置图的作用为解答的关键,注意实验操作的可行性、评价性分析,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
2.有一种MCFC型燃料电池,该电池所用燃料为H2和空气,电解质为熔融的K2CO3.电池的总反应为:2H2+O2=2H2O,负极反应:H2+CO32--2e-=H2O+CO2.下列说法正确的是( )
| A. | 电路中的电子经正极、熔融的K2CO3、负极后再到正极,形成闭合回路 | |
| B. | 电池放电时,电池中CO32-的物质的量将逐渐减少 | |
| C. | 正极反应为2H2O+O2+4e-═4OH- | |
| D. | 放电时CO32-向负极移动 |
3.下列说法错误的是( )
| A. | O3与CO2的结构相似 | |
| B. | 硫粉不溶于水,易溶于酒精,难溶于CS2中 | |
| C. | Be(OH)2是两性氢氧化物 | |
| D. | 在相同条件下,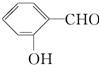 的沸点高于 的沸点高于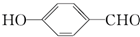 |
20.下列检验离子的方法及现象描述正确的是( )
| A. | 检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀盐酸沉淀不溶解 | |
| B. | 检验Cl-:加入AgNO3溶液出现白色沉淀 | |
| C. | 检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈浅紫色 | |
| D. | 检验NH4+:滴入浓NaOH溶液后,加热,用湿润红色石蕊试纸检验产生气体发现变蓝 |
7.下列有关酶的说法错误的是( )
| A. | 酶是具有催化作用的蛋白质 | |
| B. | 酶的催化作用具有选择性和专一性 | |
| C. | 高温或重金属盐能使酶失去生理活性 | |
| D. | 酶只有在强酸性或强碱性条件下才能发挥作用 |
17.224mL由O2和NH3组成的混合气体通过灼热的固体催化剂,充分反应后,再通过足量的水,最终收集到22.4mLO2.则原混合气体中O2的体积是(假设氨全船被氧化,气体体积均已换算成标准状况)( )
| A. | 115.75mL | B. | 134.48mL | C. | 143.75mL | D. | 156.8mL |
4.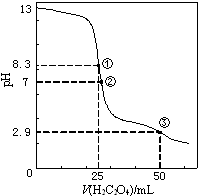 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
 25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )
25℃时,用0.0500mol•L-1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000mol•L-1NaOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-) | |
| B. | 点②所示溶液中:c(HC2O4-)+2c(C2O42-)=c(Na+)+c(H+) | |
| C. | 点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-) | |
| D. | 滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-) |
9.用已知浓度的盐酸滴定未知浓度的NaOH溶液会导致测得的NaOH溶液浓度偏高的是( )
| A. | 滴定前滴定管中有气泡,滴定后消失 | |
| B. | 碱式滴定管量取NaOH溶液时,未进行润洗操作 | |
| C. | 滴定时达到滴定终点时仰视读数 | |
| D. | 锥形瓶取用NaOH待测液前加少量水洗涤 |
10.对如图甲、乙两种化合物的结构或性质描述正确的是( )


| A. | 甲和乙互为同分异构体,均既能发生氧化反应,又能发生酯化反应 | |
| B. | 分子中共平面的碳原子数相同 | |
| C. | 可用红外光谱区分,但不能用核磁共振氢谱区分 | |
| D. | 均能与溴水反应 |