题目内容
17.224mL由O2和NH3组成的混合气体通过灼热的固体催化剂,充分反应后,再通过足量的水,最终收集到22.4mLO2.则原混合气体中O2的体积是(假设氨全船被氧化,气体体积均已换算成标准状况)( )| A. | 115.75mL | B. | 134.48mL | C. | 143.75mL | D. | 156.8mL |
分析 发生反应为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,剩余的22.4mL气体可能为氧气,有可能是NO,设出混合气体中氨气体积为x、氧气体积为y,然后分别根据剩余气体为氧气、NO结合反应方程式列式计算即可.
解答 解:最终收集到22.4mL气体可能为氧气,有可能为NO,
当剩余气体为氧气时,发生反应有:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,设氧气总体积为y,氨气总体积为x,则:①x+y=224mL;由于氨气完全反应,则x体积氨气消耗氧气体积为:x×$\frac{5}{4}$=$\frac{5}{4}$x,同时生成NO体积为x,生成的NO完全反应消耗氧气的体积为:x×$\frac{3}{4}$=$\frac{3}{4}$x,则:②$\frac{5}{4}$x+$\frac{3}{4}$x+22.4mL=y,联立①②解得:x=67.2mL、y=156.8mL,即:氧气体积为156.8mL;
当剩余的气体为NO时,则氧气、氨气完全反应,发生反应为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,剩余的22.4mL为NO,设原混合气体中氨气体积为x、氧气体积为y,则:③x+y=224mL,氨气完全反应消耗氧气体积为x×$\frac{5}{4}$=$\frac{5}{4}$x,同时生成NO体积为x,其中转化成硝酸的NO体积为:(x-22.4)mL,此过程中消耗氧气体积为:(x-22.4mL)×$\frac{3}{4}$,消耗氧气总体积为:④$\frac{5}{4}$x+(x-22.4mL)×$\frac{3}{4}$=y,联立③④可得:x=80.27mL、y=143.73mL,即:原混合气体中氧气的总体积为143.73mL,
根据分析可知,原混合气体中氧气总体积可能为:156.8mL或143.73mL,
故选CD.
点评 本题考查了混合物反应的计算,题目难度较大,明确剩余气体组成为解答关键,注意掌握讨论法在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力.

①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使酸性KMnO4溶液褪色⑥与AgNO3溶液生成白色沉淀,⑦聚合反应.
| A. | 以上反应均可发生 | B. | 只有⑦不能发生 | ||
| C. | 只有⑥不能发生 | D. | 只有②不能发生 |
| A. | 天然气隔绝空气高温分解生成炭黑和氢气 | |
| B. | 石油分馏得到汽油、煤油和柴油 | |
| C. | 石油裂解得到乙烯、丙烯、丁二烯 | |
| D. | 煤干馏生成焦炭、煤焦油、焦炉气和粗氨水 |
| A. | 燃烧 | B. | 银镜反应 | ||
| C. | 水解反应 | D. | 与新制备的Cu(OH)2反应 |

| A. | 用图1所示装置,制备并收集少量NO2气体 | |
| B. | 用图2所示装置,除去CO2中的HCl | |
| C. | 装置3向左推动针筒活塞可检验该装置的气密性 | |
| D. | 用图4所示装置,所示装置制取并收集干燥纯净的NH3 |
| A. | 节日燃放的烟花,就是碱金属以及锶、钡等金属化合物焰色反应所呈现的色彩 | |
| B. | 铝制饭盒不宜长时间存放酸性或碱性的食物 | |
| C. | 可以用ClO2、O2代替Cl2对自来水进行消毒 | |
| D. | 玛瑙饰物的主要成分与制造计算机芯片的主要成分相同 |
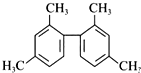
| A. | 该物质所有原子均可共面 | |
| B. | 分子中至少有10个碳原子处于同一平面上 | |
| C. | 分子中至少有11个碳原子处于同一平面上 | |
| D. | 该有机物苯环上的一溴代物有6种 |