题目内容
(15分)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:

(1)在第①步反应中,为加快反应速率,可采取的措施有 (任写一种),产生CO2气体的的方程式是 ;
(2)写出步骤②中所发生的离子方程式 ;
(3)如果蒸发得到的固体中,只含NaClO3和NaCl,为得到比较纯的NaClO3溶液,结合下面各物质的溶解度与温度的关系,

其基本操作是:将固体溶于适量水,通过 , ,便可得到较纯的NaClO3溶液。
(4)工业上也常用石墨做电极,电解酸化的MnSO4溶液来制MnO2,则阳极上所发生的离子方程式 。
(1)适当升温或充分搅拌或将样品研磨成粉末(任答一个,2分)
MnCO3 + H2SO4=MnSO4+CO2↑+H2O (3分,配平错或无气体符号合扣1分)
(2) 5Mn2+ + 2ClO3- + 4H2O = 5MnO2↓+Cl2↑+8H+(3分)
(3) 蒸发结晶、趁热过滤(各2分,共4分,无“趁热”扣1分)
(4)Mn2++2H2O-2e-=MnO2+4H+ (3分,配平错扣1分)
【解析】
试题分析:(1)对应固体与液体之间的化学反应,要加快反应速率,一般可以通过升高温度或增大反应物浓度或增大固体反应物的表面积来实现,即适当升温或充分搅拌或将样品研磨成粉末等来加快发烟硫酸;由于粗二氧化锰中含有碳酸锰,碳酸盐能与稀硫酸反应放出CO2气体,所以产生CO2气体的的方程式是MnCO3 + H2SO4=MnSO4+CO2↑+H2O;
(2)滤液中含有二价锰离子,氯酸钾具有强氧化性,能把锰离子氧化为二氧化锰。根据流程图可知还原产物是氯气,则反应的离子方程式为5Mn2+ + 2ClO3- + 4H2O = 5MnO2↓+Cl2↑+8H+;
(3)根据物质的溶解度与温度的关系可知氯酸钠的溶解度受温度影响较大,则要为得到比较纯的 NaClO3溶液,其正确的操作是将固体溶于适量水,通过蒸发结晶、趁热过滤,便可得到较纯的NaClO3溶液。
(4)电解池中阳极失去电子,硫酸锰转化为二氧化锰,锰元素化合价升高,则锰离子在阳极放电,因此阳极电极反应式为Mn2++2H2O-2e-=MnO2+4H+。
考点:考查物质制备工艺流程图的有关分析与应用

 名校课堂系列答案
名校课堂系列答案根据下列实验现象,所得结论错误的是

实验 | 实验现象 | 结论 |
A | Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡 | 活动性:Al>Fe>Cu |
B | 试管中收集到无色气体 | 铜与浓硝酸反应产物是NO |
C | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D | 长颈漏斗内液面高于烧瓶内液面且保持不变 | 装置气密性良好 |
T1温度下,反应2SO2(g)+O2(g)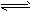 2SO3(g) △H<0的平衡常数K=532.4。
2SO3(g) △H<0的平衡常数K=532.4。
(1)该反应平衡常数的表达式为K= ,T1温度下,某时刻测得体系中各物质浓度分别为c(SO2)=0.0600 mol·L-1,c(O2)=0.400 mol·L-1,c(SO3)=2.000mol·L-1,此时反应进行的方向为 。
(2)该反应△S 0,升高温度,平衡常数 (填“增大”“减小”或“不变”)
(3)T2温度下,2L容积固定的甲、乙两密闭容器中发生上述反应,测得平衡时有关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 2molSO2、1molO2 | 4molSO3 |
平衡时n(SO3)/mol | 1 | m |
反应物的转化率 | ?1 | ?2 |
①下列能说明T2温度下甲容器中上述反应已达到平衡状态的是 。
A.SO2、O2、SO3的物质的量浓度之比为2:1:2
B.容器内气体压强不再变化
C.单位时间内2v(SO2)消耗= v(O2)生成
D.容器内混合气体的密度不再变化
②分析表格中数据,?1+?2 1(填“>”“=”或“<”),T1 T2(填“>”“=”或“<”)。
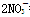 ===3Fe2++2NO↑+4H2O
===3Fe2++2NO↑+4H2O