题目内容
短周期主族元素X、Y、Z、R、W的原子序数逐渐增大,X原子的p轨道半充满,且X、Y、Z同周期,Y与R的价电子数相同.
(1)在化合物YZ2中中心原子的VSEPR模型为 ,Y与Na的离子半径由小到大的顺序为 ;
(2)X 的常见氢化物的空间构型是 ,它的另一氢化物 X2H4 是一种火箭燃料的成分,其电子式是 ;
(3)R、W两元素电负性较强的是(写元素符号) ;写出证明这一结论的一个实验事实(用化学方程式表示) ;
(4)W的含氧酸有多种,写出其中两种的分子式 .
(1)在化合物YZ2中中心原子的VSEPR模型为
(2)X 的常见氢化物的空间构型是
(3)R、W两元素电负性较强的是(写元素符号)
(4)W的含氧酸有多种,写出其中两种的分子式
考点:判断简单分子或离子的构型,电子式,原子结构与元素周期律的关系
专题:
分析:短周期主族元素X、Y、Z、R、W的原子序数逐渐增大,X原子的p轨道半充满,应当为nP3,Y和R价电子数相同,说明Y和R是同主族,且X、Y、Z同周期,即X、Y、Z为第二周期,则X为N元素,Y为O元素,Z为F元素,R为S元素,则W为Cl元素.
解答:
解:短周期主族元素X、Y、Z、R、W的原子序数逐渐增大,X原子的p轨道半充满,应当为nP3,Y和R价电子数相同,说明Y和R是同主族,且X、Y、Z同周期,即X、Y、Z为第二周期,则X为N元素,Y为O元素,Z为F元素,R为S元素,则W为Cl元素,
(1)Y为O元素,Z为F元素,OF2分子中O原子的电子对数为2+
=4,其VSEPR模型为四面体形;
核外电子数相同的微粒,质子数越多半径越小,故O与Na的离子半径由小到大的顺序为r(Na+)<r(O2-);
故答案为:四面体形;r(Na+)<r(O2-);
(2)X为N元素,NH3分子中N原子的电子对数为3+-
=4,由于有一对孤电子对,所以NH3的常见氢化物的空间构型是三角锥形;N2H4的电子式为 ;
;
故答案为:三角锥形; ;
;
(3)R为S元素,W为Cl元素,同周期元素电负性从左到右逐渐增大,故电负性较强的是Cl,电负性越强,非金属性越强,氧化性越强,氯气能把S给置换出来,例如Cl2+H2 S=S+HCl;
故答案为:Cl;Cl2+H2 S=S+HCl;
(4)W为Cl元素,其化合价有+1价、+3价、+5价和+7价等,故其含氧酸有HClO、HClO2、HClO3、HClO4等.
故答案为:HClO、HClO2、HClO3、HClO4中的任意两种.
(1)Y为O元素,Z为F元素,OF2分子中O原子的电子对数为2+
| 6-1×2 |
| 2 |
核外电子数相同的微粒,质子数越多半径越小,故O与Na的离子半径由小到大的顺序为r(Na+)<r(O2-);
故答案为:四面体形;r(Na+)<r(O2-);
(2)X为N元素,NH3分子中N原子的电子对数为3+-
| 5-1×3 |
| 2 |
 ;
;故答案为:三角锥形;
 ;
;(3)R为S元素,W为Cl元素,同周期元素电负性从左到右逐渐增大,故电负性较强的是Cl,电负性越强,非金属性越强,氧化性越强,氯气能把S给置换出来,例如Cl2+H2 S=S+HCl;
故答案为:Cl;Cl2+H2 S=S+HCl;
(4)W为Cl元素,其化合价有+1价、+3价、+5价和+7价等,故其含氧酸有HClO、HClO2、HClO3、HClO4等.
故答案为:HClO、HClO2、HClO3、HClO4中的任意两种.
点评:本题考查了判断简单分子构型、电子式、原子结构和元素周期律等知识,难度中等,注意基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A、标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为7/22.4NA |
| B、1 mol甲基(-CH3)所含的电子总数为9NA |
| C、0.5 摩1,3-丁二烯分子中含有C=C双键数为 NA |
| D、1 mol碳正离子(CH+3)所含的电子总数为8NA |
下列物理量中,不能由阿伏加德罗常数(NA)、一个水分子的质量(m水)和一个水分子的体积(V水)确定的是( )
| A、1 mol液态水的质量 |
| B、1 mol水蒸气的质量 |
| C、1 mol液态水的体积 |
| D、1 mol水蒸气的体积 |
钠着火时,可用来灭火的物质或器材是( )
| A、自来水 | B、沙土 |
| C、泡沫灭火器 | D、干粉灭火器 |
常温时,等体积等物质的量浓度的下列物质的溶液中,水的电离程度由大到小顺序排列正确的是( )
①Na2CO3 ②NaHSO4 ③CH3COOH ④NaHCO3.
①Na2CO3 ②NaHSO4 ③CH3COOH ④NaHCO3.
| A、①>②>③>④ |
| B、①>④>③>② |
| C、②>①>③>④ |
| D、②>③>④>① |
下列化学用语表达正确的是( )
| A、N2的结构式::N≡N: |
B、NaCl的电子式: |
| C、Cr的价层电子排布图:3d54s1 |
D、F-的结构示意图: |
 有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO32-、Cl-、NO3-等离子中的若干种.现做如下实验:
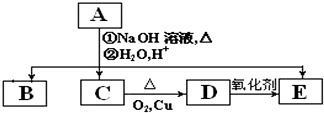
有一无色透明溶液,可能含Al3+、Fe3+、Mg2+、Na+、CO32-、Cl-、NO3-等离子中的若干种.现做如下实验: -COOH.A、B、C、D、E的相互转化关系如图所示:
-COOH.A、B、C、D、E的相互转化关系如图所示: