题目内容
1.化学反应可视为旧键断裂和新键形成的过程.共价键的键能是两种原子间形成共价键(或其逆过程)时释放(或吸收)的能量.己知H-H键能为436kJ/mol,H-N键能为391kJ/mol,根据化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,则N≡N键的键能是( )| A. | 431kJ/mol | B. | 946 kJ/mol | C. | 649 kJ/mol | D. | 869 kJ/mol |
分析 焓变等于反应物中键能之和减去生成物中键能之和,以此来解答.
解答 解:H-H键能为436kJ/mol,H-N键能为391kJ/mol,设N≡N键的键能为x,
N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,
则x+3×436kJ/mol-2×3×391kJ/mol=-92kJ/mol,
解得x=946 kJ/mol,
故选B.
点评 本题考查反应热与焓变,为高频考点,把握焓变与键能的关系为解答的关键,侧重分析与应用能力的考查,注意化学键数目的判断,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
11.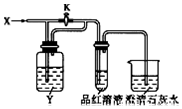 向如图装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色,加热后又恢复红色.据此判断气体X和洗气瓶内溶液Y分别可能是( )
向如图装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色,加热后又恢复红色.据此判断气体X和洗气瓶内溶液Y分别可能是( )
 向如图装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色,加热后又恢复红色.据此判断气体X和洗气瓶内溶液Y分别可能是( )
向如图装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色,加热后又恢复红色.据此判断气体X和洗气瓶内溶液Y分别可能是( )| A | B | C | D | |
| X | C12 | NO2 | HCl | SO2 |
| Y | Na2SO3溶液 | 水 | Na2SO3溶液 | 饱和NaHCO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
12.对实验Ⅰ~Ⅳ的叙述正确的是( )
| A. |  如图实验:用托盘天平称量一定质量的氯化钠固体 | |
| B. | 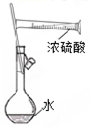 如图实验:配制一定物质的量浓度的硫酸 | |
| C. | 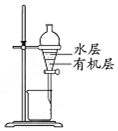 如图实验:用苯萃取溴水中的溴后进行分液 | |
| D. | 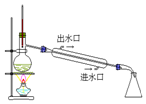 如图实验:用于蒸馏,分离四氯化碳和溴 |
9.如表所示,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | NaHCO3可用于治疗胃病 | NaHCO3可与盐酸反应 | Ⅰ对,Ⅱ对,无 |
| B | 向滴有酚酞的水溶液中加入Na2O2变红色 | Na2O2与水反应生成氢氧化钠 | Ⅰ对,Ⅱ错,无 |
| C | 金属钠具有强还原性 | 高压钠灯发出透雾性强的黄光 | Ⅰ对,Ⅱ对,有 |
| D | Na2O2可为航天员供氧 | Na2O2能与CO2和H2O反应生成O2 | Ⅰ对,Ⅱ对,有 |
| A. | A | B. | B | C. | C | D. | D |
16.黑火药是我国古代四大发明之一,配方为‘一硫二硝三木炭”,下列说法中不正确的是( )
| A. | 硝是指硝酸钾 | B. | 黑火药爆炸是氧化还原反应 | ||
| C. | 反应放热并产生大量气体 | D. | 木炭在反应中被还原 |
6.化学反应 A2(g)+B2(g)?2AB(g)的能量变化如图所示,下列叙述中正确的是( )
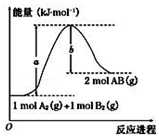

| A. | 每生成 2 个分子 AB 吸收(a-b) kJ 热量 | |
| B. | 该反应热△H=+(a-b)kJ•mol-1 | |
| C. | 逆反应的活化能高于正反应的活化能 | |
| D. | 断裂1mol A-A 和 1mol B-B 键,放出 a kJ 能量 |
13.下列变化属于还原反应的是( )
| A. | Fe→FeSO4 | B. | Cu(NO3)2→Cu | C. | CO→CO2 | D. | NaCl→AgCl |
8.关于碘及其化合物的说法正确的是( )
| A. | “碘遇淀粉变蓝色”,“碘”指碘元素 | |
| B. | 为了补碘,要多食用含高碘酸的食物 | |
| C. | 碘水中加入CCl4后,充分混合后静置分层.CCl4在下层,呈现紫红色.如果在太空实验室中混合这两种液体,CCl4就未必在下层 | |
| D. | 通过“取样→灼烧→溶解→过滤→萃取”可从海带中提取单质碘 |