题目内容
8.关于碘及其化合物的说法正确的是( )| A. | “碘遇淀粉变蓝色”,“碘”指碘元素 | |
| B. | 为了补碘,要多食用含高碘酸的食物 | |
| C. | 碘水中加入CCl4后,充分混合后静置分层.CCl4在下层,呈现紫红色.如果在太空实验室中混合这两种液体,CCl4就未必在下层 | |
| D. | 通过“取样→灼烧→溶解→过滤→萃取”可从海带中提取单质碘 |
分析 A.“碘遇淀粉变蓝色”,“碘”指碘单质;
B.高碘酸中碘为+5价,具有很强的氧化性;
C.碘不易溶于水,易溶于四氯化碳,且四氯化碳的不溶于水、密度比水大,在太空实验室中失重;
D.从海带中提取单质碘通过“取样→灼烧→溶解→过滤→氧化→萃取→蒸馏等操作.
解答 解:A.碘单质和淀粉形成络合物呈现蓝色,而碘的化合物不具备该性质,故A错误;
B.高碘酸具有强烈的氧化性和腐蚀性,不能食用,补碘,可多食海带等含碘的物质,故B错误;
C.碘不易溶于水,易溶于四氯化碳,且四氯化碳的不溶于水、密度比水大,则碘水中加入适量的CCl4振荡后,分层,且上层为无色,下层为紫红色,如果在太空实验室中混合这两种液体,因失重CCl4就未必在下层,故C正确;
D.从海带中提取单质碘通过“取样→灼烧将有机物转化为无机盐,→溶解将含碘的化合物转变在溶液中→过滤,将杂质滤去→氧化将碘离子氧化成碘单质→通过萃取将碘单质萃取出→通过蒸馏等到碘单质,故D错误;
故选C.
点评 本题主要考查了碘及其化合物的性质,掌握碘单质遇淀粉变蓝以及从海带中提取单质碘的原理是解答本题的关键,题目难度中等.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案
相关题目
1.化学反应可视为旧键断裂和新键形成的过程.共价键的键能是两种原子间形成共价键(或其逆过程)时释放(或吸收)的能量.己知H-H键能为436kJ/mol,H-N键能为391kJ/mol,根据化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,则N≡N键的键能是( )
| A. | 431kJ/mol | B. | 946 kJ/mol | C. | 649 kJ/mol | D. | 869 kJ/mol |
16.将下列各组物质按酸、碱、盐分类顺次排列,其中正确的是( )
| A. | 硫酸 纯碱 孔雀石 | B. | 硝酸 烧碱 明矾 | ||
| C. | 醋酸 乙醇 碳酸钙 | D. | 盐酸 熟石灰 苛性钠 |
13.根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | Cl- | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| ③ | KClO3 | 浓盐酸 | Cl2 |
| A. | 表中①组的反应可能有一种或两种元素被氧化 | |
| B. | 氧化性哟弱的比较:KClO3>Fe3+>Br2>Cl2 | |
| C. | 表中③组反应的还原产物是KCl,电子转移数目是6e | |
| D. | 表中②组反应的化学方程式为:2KMnO4+3H2O2+3H2SO4→2MnSO4+K2SO4+4O2↑+6H2O |
20.按卤素原子核电荷数递增的顺序,下列各项变小或减弱的是( )
| A. | 原子半径 | B. | 简单离子的还原性 | ||
| C. | 单质的熔沸点 | D. | 氢化物的稳定性 |
17.下列离子方程式正确的是( )
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | FeCl2溶液中加入氯水:Cl2+Fe2+═Fe3++2Cl- | |
| C. | 碳酸氢钠与稀硫酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | NaOH溶液与小苏打溶液反应 HCO3-+OH-═CO32-+H2O |
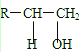 $→_{△}^{浓硫酸}$R-CH=CH2+H2O,叫做消去反应
$→_{△}^{浓硫酸}$R-CH=CH2+H2O,叫做消去反应