题目内容
已知A、B、C、D、E、F、G是七种原子序数依次增大的短周期元素,它们的原子结构特征或有关物质的性质等如表所示.
(1)元素A的元素符号是 .元素D在元素周期表中的位置是第 周期、第ⅡA族.这七种元素中,不属于主族元素的元素的名称是 .
(2)B原子的原子结构示意图为 .在E、F、G三种元素中,原子半径最小的是 (填元素名称).
(3)元素A与G可形成化合物AG4,在该化合物中含有的化学键类型为 .A与氧元素可形成化合物AO2,该化合物分子的电子式为 .
(4)在D、E、F三种元素的最高价氧化物对应的水化物中,呈碱性的是 (填化学式).
(5)元素B能与氢元素形成化合物BH3,在通常状况下,BH3的水溶液呈 (填“酸”、“碱”或“中”)性.
(6)元素E的单质、氧化物和氢氧化物都能与NaOH溶液反应,且反应时都有盐生成,则生成的盐的化学式为 .
| 元素 | 原子结构特征或有关物质的性质 |
| A | 原子的最外层电子数是其内层电子数的2倍 |
| B | 其单质是空气中含量最多的物质 |
| C | 原子的最外层电子数是其电子层数的4倍 |
| D | 位于第ⅡA族,其原子半径比E的大 |
| E | 是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
| F | 原子序数16,其单质在通常状况下为固体 |
| G | 原子的最外层电子数比其次外层电子数少1个 |
(2)B原子的原子结构示意图为
(3)元素A与G可形成化合物AG4,在该化合物中含有的化学键类型为
(4)在D、E、F三种元素的最高价氧化物对应的水化物中,呈碱性的是
(5)元素B能与氢元素形成化合物BH3,在通常状况下,BH3的水溶液呈
(6)元素E的单质、氧化物和氢氧化物都能与NaOH溶液反应,且反应时都有盐生成,则生成的盐的化学式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F、G是七种原子序数依次增大的短周期元素,A原子的最外层电子数是其内层电子数的2倍,A原子只能有2个电子层,最外层电子数是4,则A为碳元素;B的单质是空气中含量最多的物质,则B为N元素;C原子的最外层电子数是其电子层数的4倍,原子核外只能有2个电子层,最外层电子数为8,则C为Ne;D位于第ⅡA族,结合原子序数可知D为Mg;E是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期,则E为Al;F原子序数16,其单质在通常状况下为固体,则F为S;G原子的最外层电子数比其次外层电子数少1个,原子序数大于S,处于第三周期,则最外层电子数为7,故G为Cl,据此解答.
解答:
解:A、B、C、D、E、F、G是七种原子序数依次增大的短周期元素,A原子的最外层电子数是其内层电子数的2倍,A原子只能有2个电子层,最外层电子数是4,则A为碳元素;B的单质是空气中含量最多的物质,则B为N元素;C原子的最外层电子数是其电子层数的4倍,原子核外只能有2个电子层,最外层电子数为8,则C为Ne;D位于第ⅡA族,结合原子序数可知D为Mg;E是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期,则E为Al;F原子序数16,其单质在通常状况下为固体,则F为S;G原子的最外层电子数比其次外层电子数少1个,原子序数大于S,处于第三周期,则最外层电子数为7,故G为Cl,
(1)由上述分析可知,元素A的元素符号是C.元素D为Mg,处于第三周期ⅡA族,这七种元素中,不属于主族元素的元素的名称是氖,
故答案为:C;三;氖;
(2)B为N元素,原子的原子结构示意图为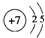 .Al、S、Cl三种元素处于同周期,随原子序数增大原子半径减小,故原子半径最小的是氯,
.Al、S、Cl三种元素处于同周期,随原子序数增大原子半径减小,故原子半径最小的是氯,
故答案为: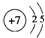 ;氯;
;氯;
(3)元素C与Cl形成化合物CCl4,含有的化学键类型为共价键;C与氧元素形成化合物CO2,分子中C原子与O原子之间形成2对共用电子对,其电子式为 ,
,
故答案为:共价键; ;
;
(4)在Mg、Al、S三种元素的最高价氧化物对应的水化物中,呈碱性的是Mg(OH)2,
故答案为:Mg(OH)2;
(5)元素N能与氢元素形成化合物NH3,在通常状况下,NH3的水溶液呈碱性,
故答案为:碱;
(6)Al的单质、氧化物和氢氧化物都能与NaOH溶液反应生成偏铝酸钠,生成的盐的化学式为NaAlO2,
故答案为:NaAlO2.
(1)由上述分析可知,元素A的元素符号是C.元素D为Mg,处于第三周期ⅡA族,这七种元素中,不属于主族元素的元素的名称是氖,
故答案为:C;三;氖;
(2)B为N元素,原子的原子结构示意图为
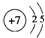 .Al、S、Cl三种元素处于同周期,随原子序数增大原子半径减小,故原子半径最小的是氯,
.Al、S、Cl三种元素处于同周期,随原子序数增大原子半径减小,故原子半径最小的是氯,故答案为:
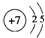 ;氯;
;氯;(3)元素C与Cl形成化合物CCl4,含有的化学键类型为共价键;C与氧元素形成化合物CO2,分子中C原子与O原子之间形成2对共用电子对,其电子式为
 ,
,故答案为:共价键;
 ;
;(4)在Mg、Al、S三种元素的最高价氧化物对应的水化物中,呈碱性的是Mg(OH)2,
故答案为:Mg(OH)2;
(5)元素N能与氢元素形成化合物NH3,在通常状况下,NH3的水溶液呈碱性,
故答案为:碱;
(6)Al的单质、氧化物和氢氧化物都能与NaOH溶液反应生成偏铝酸钠,生成的盐的化学式为NaAlO2,
故答案为:NaAlO2.
点评:本题考查结构性质位置关系应用,难度不大,推断元素是解题的关键,注意对基础知识的全面掌握.

练习册系列答案
相关题目
能正确表示下列反应的离子方程式是( )
A、实验室用大理石和稀盐酸制取CO2:2H++C
| ||
| B、金属钠与足量水反应:Na+2H2O=Na++H2↑+2OH- | ||
C、氢氧化钡溶液中加入稀硫酸:Ba2++S
| ||
| D、Cl2与水反应:Cl2+H2O=H++Cl-+HClO |
将各为a g 的下列物质分别加入b g 足量稀硫酸中,充分反应后溶液的质量为(a+b)的是( )
| A、铁片 | B、碳酸氢钠 |
| C、氢氧化铜 | D、氯化钡 |
不能证明HA是弱酸的是( )
| A、常温下,NaA溶液的pH=9 |
| B、0.01 mol?L-1HA溶液的pH=4 |
| C、pH=2的HA溶液稀释100倍后pH=3.5 |
| D、HA溶液跟锌反应,放出H2很慢 |



