题目内容
3.CO2通入下列溶液中,不可能产生沉淀的是( )| A. | 氯化钙溶液 | B. | 澄清石灰水 | C. | 饱和碳酸钠溶液 | D. | 次氯酸钙溶液 |
分析 A.二氧化碳和氯化钙溶液不发生反应;
B.二氧化碳与过量氢氧化钙反应生成碳酸钙和水;
C.碳酸钠与二氧化碳和水反应生成溶解度较小的NaHCO3;
D.碳酸酸性强于次氯酸,二氧化碳与过量次氯酸钙反应生成次氯酸和碳酸钙.
解答 解:A.碳酸的酸性弱于盐酸,所以二氧化碳与氯化钙溶液不反应,不产生沉淀,故A正确;
B.二氧化碳与过量氢氧化钙反应生成碳酸钙和水,碳酸钙为白色沉淀,故B错误;
C.碳酸钠与二氧化碳和水反应,既消耗了水,且反应生成溶解度较小的NaHCO3,所以一定有沉淀析出,故C错误;
D.碳酸酸性强于次氯酸,二氧化碳与过量次氯酸钙反应生成次氯酸和碳酸钙,所以会产生白色沉淀,故D错误;
故选:A.
点评 本题考查了离子反应发生的条件,明确离子反应发生的条件、掌握常见元素化合物的化学性质是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.对于相同物质的量的S02和S03,下列说法中正确的是( )
| A. | 氧元素的质量比为1:1 | B. | 质量之比为1:1 | ||
| C. | 原子总数之比为1:1 | D. | 硫元素的质量比为1:1 |
18.下列化合物不能由两种单质直接化合而生成的是( )
| A. | FeC12 | B. | Cu2S | C. | Mg3N2 | D. | Na2O2 |
8.把一瓶不饱和的烧碱溶液分成4等份.保持温度不变,向4份溶液中分别加入一定量的NaOH固体、Na2O2、Na2O和Na,使溶液均恰好饱和,下列说法中正确的是( )
| A. | 加入的NaOH质量不一定最大 | |
| B. | 加入的Na2O2和Na2O的物质的量之比为1:1 | |
| C. | 制成饱和溶液后,4份溶液中所含NaOH质量相同 | |
| D. | 加入的NaOH、Na2O2、Na2O、Na的物质的量之比为2:1:1:2 |
15.镁及铁是用途很广的金属材料,某学校研究性学习小组从工业废水(主要含Mg2+、Fe3+、Cl-)中模拟工业生产来提取镁和铁,主要过程如下:回答下列问题

(1)试剂①可以是AB
A.MgCO3 B.Mg(OH)2C.NaOH D.NH3•H2O
其目的是使溶液的pH升高,使Fe3+转化为氢氧化铁沉淀而分离出去.
(2)图1是该校研究性学习小组设计进行过程③的实验装置图.其中装置A的作用是制备干燥的HCl气体,抑制MgCl2的水解.
(3)为了分析废水中铁元素的含量,先将废水预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液自身可作指示剂.
②下列滴定操作可使测量结果偏大的是ACD.
A.锥形瓶水洗后.用待测液润洗过再装待测液.
B.滴定前读数仰视.滴定后读数俯视.
C.滴定管水洗后.未用标准液洗涤.
D.滴定管装液后尖嘴部位有气泡,滴定后气泡消失
③某同学称取5.000g废水,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.三次实验的实验数据如下表所示.,则废水中铁元素的质量分数是4.480%.
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Fe3+ | 2.7 | 3.7 |

(1)试剂①可以是AB
A.MgCO3 B.Mg(OH)2C.NaOH D.NH3•H2O
其目的是使溶液的pH升高,使Fe3+转化为氢氧化铁沉淀而分离出去.
(2)图1是该校研究性学习小组设计进行过程③的实验装置图.其中装置A的作用是制备干燥的HCl气体,抑制MgCl2的水解.
(3)为了分析废水中铁元素的含量,先将废水预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?否(填“是”或“否”),请说明理由KMnO4溶液自身可作指示剂.
②下列滴定操作可使测量结果偏大的是ACD.
A.锥形瓶水洗后.用待测液润洗过再装待测液.
B.滴定前读数仰视.滴定后读数俯视.
C.滴定管水洗后.未用标准液洗涤.
D.滴定管装液后尖嘴部位有气泡,滴定后气泡消失
③某同学称取5.000g废水,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10-2mol•L-1KMnO4标准溶液滴定.三次实验的实验数据如下表所示.,则废水中铁元素的质量分数是4.480%.
| 实验 编号 | 待测溶液的体积(mL) | 滴定前标液的 体积读数(mL) | 滴定后标液的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 21.22 |
| 2 | 20.00 | 2.21 | 22.19 |
| 3 | 20.00 | 1.50 | 23.48 |
13.已知,还原性HSO3->Cl-,氧化性ClO3->Cl2.
实验Ⅰ:在一定量NaHSO3的溶液中逐滴加入KClO3溶液至过量;
实验Ⅱ:在一定量的KClO3溶液中逐滴加NaHSO3溶液至过量,下列说法正确的是( )
实验Ⅰ:在一定量NaHSO3的溶液中逐滴加入KClO3溶液至过量;
实验Ⅱ:在一定量的KClO3溶液中逐滴加NaHSO3溶液至过量,下列说法正确的是( )
| A. | 实验Ⅰ中溶液的酸性不断增强 | |
| B. | 两实验中生成等量Cl2时,转移电子数的物质的量相同 | |
| C. | 在实验Ⅰ的过程中,若NaHSO3初始量为3mol,当溶液中Cl-与Cl2的物质的量之比为5:2时,氧化产物为3.2mol | |
| D. | 试验Ⅱ反应结束后,加入碘化钾溶液,溶液呈蓝色 |

 .
.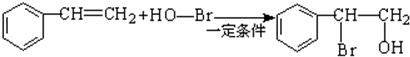 .
.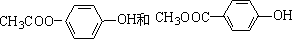 .
. )的合成线路:
)的合成线路: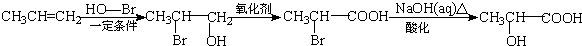 .
.