题目内容
20.下列金属与水反应最剧烈的是( )| A. | Ca | B. | Li | C. | K | D. | Na |
分析 同周期从右向左金属性越来越强,同主族从上向下金属性越来越强,金属性越强,与水反应越剧烈,据此分析.
解答 解:同周期从右向左金属性越来越强,同主族从上向下金属性越来越强,金属性越强,与水反应越剧烈,金属性:K>Ca>Na>Li,所以K与水反应最剧烈,故C正确;
故选C.
点评 本题考查了元素周期律,题目难度不大,侧重于考查同主族和同周期金属元素性质的递变规律,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列实验操作中正确的是( )
| A. | 蒸发结晶时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 过滤时,溶液的液面高于滤纸的边缘 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从上口倒到另一个烧杯中 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
11.表是元素周期表的一部分,针对表中①一⑨元素,填写下列空白.
(1)④的原子半径比⑤的原于半径大 (填“大”或“小”).
(2)⑧的原子结构示意图为 .
.
(3)①、②、③的非金属性依次增强(填“增强”或“减弱”).
(4)由氢与⑦所形成的化合物的分子式是H2S.
(5)④、⑤和⑥的氧化物对应的水化物中碱性较强的是NaOH(写化学式).
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)⑧的原子结构示意图为
 .
.(3)①、②、③的非金属性依次增强(填“增强”或“减弱”).
(4)由氢与⑦所形成的化合物的分子式是H2S.
(5)④、⑤和⑥的氧化物对应的水化物中碱性较强的是NaOH(写化学式).
8.下列关系中能说明反应:NH4HS(s)?NH3(g)+H2S(g)已经达到平衡状态的是( )
| A. | υ正(NH3)=υ正(H2S) | B. | υ正(NH3)=υ逆(H2S) | C. | υ逆(NH3)=υ逆(H2S) | D. | υ(NH3)=υ(H2S) |
12.下列说法正确的是( )
| A. | 最外层电子数等于或大于3(小于8)的元素一定是主族元素 | |
| B. | 元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱 | |
| C. | 在主族元素中,最高正化合价均等于主族序数 | |
| D. | 元素的原子得电子越多,非金属性越强;失电子越多,金属性越强 |
9.某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如图: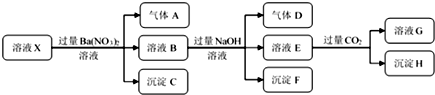
下列有关推断合理的是( )

下列有关推断合理的是( )
| A. | 若要确定溶液X中是否含有Fe3+,其操作为取少量原溶液于试管中,加入适量KSCN溶液,溶液变血红色,则含有Fe3+ | |
| B. | 沉淀C为BaSO4,沉淀H为BaCO3,工业上往BaCO3中加入饱和的Na2CO3可以实现BaSO4的转变 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol•L-1 |
10.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 硼的氧化物的水化物可能具有两性 | |
| B. | 砹(At)为有色固体,HAt不稳定,AgAt见光容易分解,但不溶于水也不溶于稀酸 | |
| C. | 氢氧化铷(RbOH)易溶于水 | |
| D. | 硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
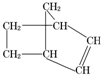 降冰片烯的分子结构如图:
降冰片烯的分子结构如图: