题目内容
 能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
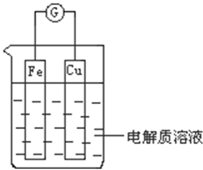
能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.(1)如图所示,组成一个原电池.
①当电解质溶液为稀硫酸时:
Cu电极是
②当电解质溶液为浓硝酸时:
Cu电极是
(2)请写出用惰性电极电解硫酸铜溶液的化学方程式
(3)燃烧氢气时耗氧量小,放出热量多.已知4g H2燃烧生成液态水时放热为571.6kJ,试写出表示H2标准燃烧热的热化学方程式:
考点:原电池和电解池的工作原理,热化学方程式
专题:
分析:(1)在原电池中,易失电子的电极为负极,另一个电极为正极
①当电解质溶液为稀硫酸时,铁易失电子作负极、Cu作正极,正极上氢离子放电;
②当电解质溶液为浓硝酸时,铜易失电子作负极,负极上铜失电子生成铜离子;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电;
(3)4g H2的物质的量是2mol,4g H2燃烧生成液态水时放热为571.6kJ,则1mol燃烧生成液态水时放热为285.8kJ.
①当电解质溶液为稀硫酸时,铁易失电子作负极、Cu作正极,正极上氢离子放电;
②当电解质溶液为浓硝酸时,铜易失电子作负极,负极上铜失电子生成铜离子;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电;
(3)4g H2的物质的量是2mol,4g H2燃烧生成液态水时放热为571.6kJ,则1mol燃烧生成液态水时放热为285.8kJ.
解答:
解:(1)①当电解质溶液为稀硫酸时,铁易失电子作负极、Cu作正极,正极上氢离子放电,Cu电极上电极反应式为:2H++2e-=H2↑,故答案为:正;2H++2e-=H2↑;
②当电解质溶液为浓硝酸时,铁和浓硝酸发生钝化现象,所以铜易失电子作负极,负极上铜失电子生成铜离子,电极反应式为:Cu-2e-=Cu2+,故答案为:负;Cu-2e-=Cu2+;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,电池反应式为2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4;
(3)4g H2的物质的量是2mol,4g H2燃烧生成液态水时放热为571.6kJ,则1mol燃烧生成液态水时放热为285.8kJ,则氢气的燃烧热化学方程式为H2(g)+
O2(g)═H2O(l)△H=-285.6 kJ?mol-1,故答案为:H2(g)+
O2(g)═H2O(l)△H=-285.6 kJ?mol-1.
②当电解质溶液为浓硝酸时,铁和浓硝酸发生钝化现象,所以铜易失电子作负极,负极上铜失电子生成铜离子,电极反应式为:Cu-2e-=Cu2+,故答案为:负;Cu-2e-=Cu2+;
(2)用惰性电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,电池反应式为2CuSO4+2H2O
| ||
| ||
(3)4g H2的物质的量是2mol,4g H2燃烧生成液态水时放热为571.6kJ,则1mol燃烧生成液态水时放热为285.8kJ,则氢气的燃烧热化学方程式为H2(g)+
| 1 |
| 2 |
| 1 |
| 2 |
点评:本题考查了原电池原理、燃烧热化学方程式的书写,根据基本概念、盖斯定律的内涵、原电池原理等知识点来分析解答,注意不能根据金属的活泼性强弱确定原电池正负极,要根据失电子的难易程度确定正负极,如:Mg、Al和NaOH溶液中铝作负极,Fe、Cu和浓硫酸或浓硝酸构成的原电池中Cu作负极,为易错点.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
下列反应的离子反应方程式书写正确的是( )
| A、少量金属钠加到冷水中:Na+H2O=Na++OH-+H2↑ |
| B、铁与稀盐酸反应:2Fe+6H+=2 Fe3++3H2↑ |
| C、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
| D、过量的二氧化碳通入氢氧化钠溶液:CO2+2OH-=CO32-+H2O |
北京时间2月25日凌晨,服役了27年的“发现”号航天飞机从美国肯尼迪航天中心发射升空,开始了为期11天的“谢幕之旅”.并于北京时间27日3时14分,成功绝唱对接国际空间站.发现号航天飞机上有各式各样电池电池的发展是化学对人类的一项重大贡献.下列有关电池的叙述正确的是( )
| A、太阳能电池的主要材料为二氧化硅 |
| B、锌锰干电池工作原理与太阳能电池工作原理相同 |
| C、氢氧燃料电池工作时氢气在负极被还原 |
| D、锂离子电池优点是提供相同的电量所需的金属质量小 |
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1 ②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,下列结论正确的是( )
| A、反应①为放热反应 |
| B、碳的燃烧热大于110.5 kJ?mol-1 |
| C、浓硫酸和NaOH反应的中和热为-57.3 kJ?mol-1 |
| D、稀醋酸与稀NaOH反应生成1mol水,放出57.3 kJ的热量 |
下列由极性键构成的非极性分子是( )
| A、N2 |
| B、HF |
| C、NH3 |
| D、CO2 |
下列离子方程式正确的是( )
A、甘氨酸(α-氨基乙酸)与氢氧化钠溶液反应: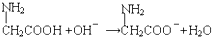 | ||
| B、高级脂肪酸与氢氧化钠溶液反应:H++OH-=H2O | ||
| C、苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | ||
D、乙醛与银氨溶液的反应:CH3CHO+2[Ag(NH3)2]++2OH-
|