题目内容
(1)欲配制500mL浓度为0.2mol/L的NaOH溶液,需要NaOH固体 g,称量固体时,应先在天平的左盘放一个 ,称出其质量,再将NaOH固体置于其中称量.然后在 里加入适量的水,将上述固体溶解,待 后,转移到500mL的容量瓶中,洗涤,定容,翻转摇匀.
(2)在实验(1)中,若其它操作均正确,但定容时俯视刻度线,则所得溶液的浓度 (填“大于”、“等于”或“小于”)0.2mol/L.
(3)在实验(1)中,若NaOH溶液在转移至容量瓶时洒落少许,则所得溶液的浓度 (填“大于”、“等于”或“小于”)0.2mol/L.
(2)在实验(1)中,若其它操作均正确,但定容时俯视刻度线,则所得溶液的浓度
(3)在实验(1)中,若NaOH溶液在转移至容量瓶时洒落少许,则所得溶液的浓度
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据n=cV、m=nM计算出需要溶质氢氧化钠的质量;氢氧化钠具有腐蚀性,应该放在烧杯中称量;溶解氢氧化钠应该在小烧杯中进行;氢氧化钠溶解过程放出热量,需要冷却后再转移溶液;
(2)定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高;
(3)NaOH溶液在转移至容量瓶时洒落少许,会导致配制的溶液中溶质的物质的量偏小.
(2)定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高;
(3)NaOH溶液在转移至容量瓶时洒落少许,会导致配制的溶液中溶质的物质的量偏小.
解答:
解:(1)500mL浓度为0.2mol/L的NaOH溶液中含有氢氧化钠的物质的量为:n(NaOH)=0.2mol/L×0.5L=0.1mol,m(NaOH)=40g/mol×0.1mol=4.0g;
称量氢氧化钠时,将氢氧化钠盛放在小烧杯中称量;将称量好的氢氧化钠放入小烧杯中溶解,待溶解的氢氧化钠溶液冷却后,转移到500mL容量瓶中,
故答案为:4.0;小烧杯;小烧杯;冷却;
(2)定容时俯视刻度线,会导致加入的蒸馏水体积偏小,配制的溶液浓度偏高,即大于0.2mol/L,故答案为:大于;
(3)若NaOH溶液在转移至容量瓶时洒落少许,会导致配制的溶液中氢氧化钠的物质的量偏小,配制的溶液浓度偏低,即小于0.2mol/L,故答案为:小于.
称量氢氧化钠时,将氢氧化钠盛放在小烧杯中称量;将称量好的氢氧化钠放入小烧杯中溶解,待溶解的氢氧化钠溶液冷却后,转移到500mL容量瓶中,
故答案为:4.0;小烧杯;小烧杯;冷却;
(2)定容时俯视刻度线,会导致加入的蒸馏水体积偏小,配制的溶液浓度偏高,即大于0.2mol/L,故答案为:大于;
(3)若NaOH溶液在转移至容量瓶时洒落少许,会导致配制的溶液中氢氧化钠的物质的量偏小,配制的溶液浓度偏低,即小于0.2mol/L,故答案为:小于.
点评:本题考查了配制一定物质的量浓度的溶液的方法及误差分析,题目难度中等,注意掌握配制一定浓度的溶液的方法,明确误差分析的方法与技巧.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
下列实验装置或操作设计正确且能达到实验目的是( )
A、 配制一定物质的量浓度的稀硫酸 |
B、 制取少量的氢氧化铁胶体 |
C、 用硫酸标准溶液滴定氢氧化钠溶液 |
D、 称取氢氧化钠固体 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、pH=1的溶液中:K+、Fe2+、MnO4-、SO42- |
| B、c(Fe3+)=0.1 mol?L-1的溶液中:K+、ClO-、SO42-、SCN- |
| C、c(H+)/c (OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| D、与铝反应生成氢气的溶液中:NH4+、K+、Cl-、SiO32- |
体积相同的盐酸和醋酸两种溶液,n(Cl-)=n(CH3COO-)=0.01mol.则下列叙述正确的是( )
| A、两种溶液的pH不相同 |
| B、它们分别与足量CaCO3反应时,放出的CO2一样多 |
| C、它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| D、分别用水稀释相同倍数时,n(Cl-)=n(CH3COO-) |
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A、1L0.25 mol/L的Na2SO4溶液中含氧原子个数为NA |
| B、12g石墨烯(单层)中含六元环的个数为0.5NA |
| C、78g苯含有碳碳双键数为3NA |
| D、电解精炼铜时每转移NA个电子,阳极溶解32g铜 |
 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: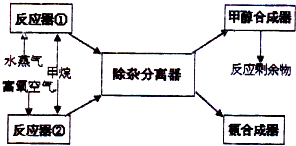 某化工厂以甲烷为主要原料来制取合成甲醇及合成氨的原料,其主要反应为:
某化工厂以甲烷为主要原料来制取合成甲醇及合成氨的原料,其主要反应为: