题目内容
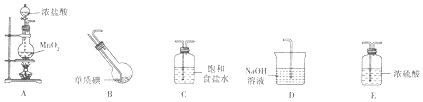
17.工业上,向500~600℃的铁屑中通入氯气生产无水氯化铁.现用如图所示的装置模拟上述过程进行实验.
(1)写出仪器的名称:a分液漏斗 b圆底烧瓶.
(2)A中反应的化学方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
C中反应的化学方程式为2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3.
(3)装置B中加入的试剂是浓硫酸.
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁.为防止有杂质FeCl2生成,可在装置A和B(填字母)间增加一个盛有饱和食盐水的洗气瓶.
(5)装置D的作用是除去过量氯气,防止其污染空气.为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:改为一个盛有碱石灰的干燥管(或在装置C和D之间增加一个盛有浓硫酸的洗气瓶).
(6)反应结束后,取少量装置C中的固体于试管中,加入足量盐酸,固体完全溶解,得到溶液X.证明溶液X中含有FeCl3的试剂是硫氰化钾溶液(或苯酚溶液),观察到的现象是溶液变为(血)红色(或溶液变为紫色).
分析 装置A是制备氯气的发生装置,生成的氯气中含氯化氢和水蒸气,通过装置B中浓硫酸干燥氯气,通过装置C反应生成无水氯化铁,剩余气体通过氢氧化钠溶液吸收,
(1)根据仪器构造可知;
(2)A为二氧化锰和浓盐酸制备氯气的反应,C为氯气与铁制备氯化铁的反应;
(3)根据为制备无水氯化铁,B装置应为干燥氯气的装置;
(4)制备的氯气中混有氯化氢气体,所以需在干燥之前除氯化氢气体;
(5)氯气污染空气,D装置除未反应完的氯气;为制备无水氯化铁,同时吸收氯气,D可选用碱石灰;
(6)检验铁离子用硫氰化钾或者苯酚.
解答 解:(1)由仪器的构造可知a为分液漏斗,b为圆底烧瓶,故答案为:分液漏斗;圆底烧瓶;
(2)A装置制取的是氯气,实验室常用浓盐酸与二氧化锰加热制取,化学反应方程式为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;C为氯气与铁制备氯化铁,反应方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(3)为制备无水氯化铁,B装置应为盛有浓硫酸的干燥氯气的装置,故答案为:浓硫酸;
(4)制备的氯气中混有氯化氢气体,所以需在干燥之前除氯化氢,故在A与B间添加饱和食盐水的装置,
故答案为:A;B;饱和食盐水;
(5)氯气污染空气,D装置用氢氧化钠除未反应完的氯气;为制备无水氯化铁,防止D中水蒸气进入C装置,可选用碱石灰的干燥管,既能吸收氯气,又能吸水,或在装置C和D之间增加一个盛有浓硫酸的洗气瓶;
故答案为:除去过量氯气,防止其污染空气;改为一个盛有碱石灰的干燥管(或在装置C和D之间增加一个盛有浓硫酸的洗气瓶);
(6)检验铁离子用硫氰化钾或者苯酚,若有铁离子,硫氰化钾溶液变红色,苯酚溶液变紫色;
故答案为:硫氰化钾溶液(或苯酚溶液);溶液变为(血)红色(或溶液变为紫色).
点评 本题以氯化铁制取为载体,考查的是实验室中氯气的制取方法、常见尾气的处理方法以及铁离子的检验等,题目难度中等.

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案| A. | CuO | B. | NH3•H2O | C. | NaOH | D. | Cu(OH)2 |
| A. | 雾霾一定是由汽车尾气引起的 | |
| B. | SO2、NO2都能引起酸雨 | |
| C. | 酸雨的pH<5.6 | |
| D. | 空气中的SO2主要来自煤和石油的燃烧 |
| A. | 形成amolCaCO3 | |
| B. | 形成bmolCaCO3 | |
| C. | 可能得到CaCO3沉淀,但沉淀量小于bmol | |
| D. | 可能最终得到澄清溶液,其中含$\frac{a}{2}$molCa2+ |
| A. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)=2H2O(l)△H=-484 kJ/mol | ||
| C. | 2H2(g)+O2(g)=2H2O(g)△H=+484kJ/mol | D. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ/mol |
| A. | Zn+2HCl═ZnCl2+H2↑ | B. | 4NH3+5O2═4NO+6H2O | ||
| C. | 2HClO═2HCl+O2↑ | D. | Ca(OH)2+CO2═CaCO3↓+H2O |
| A. | Na+、K+、NO3-、Cl- | B. | Na+、Fe3+、Cl-、OH- | ||
| C. | K+、H+、NO3-、CO32- | D. | Na+、K+、OH-、HCO3- |