题目内容
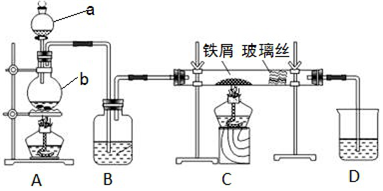
18.一氯化碘是一种红棕色液体.不溶于水,溶于乙醇和乙酸,能与KI反应生成I2,用于测定油脂中的碘值等(注:碘值表示有机物中不饱和程度的指标).某校研究性学习小组的同学拟制备一氯化碘(沸点101℃).回答下列问题:(1)甲组同学拟利用干燥纯净的氯气与碘反应制备一氯化碘,已知碘与氯气的反应为放热反应,其装置如图:
①各装置连接顺序为A→C→E→B→D;A中发生反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
②B装置烧瓶需放在冷水中,其目的是防止ICl挥发;D装置的作用是吸收未反应的氯气.
③B装置得到的液态产物进一步提纯可得到较纯净的ICl,采取的方法是蒸馏,收集101℃的馏分.
(2)乙组同学采用最新报道制一氯化碘的方法,在三颈烧瓶中加人粗碘和盐酸,控制温度约50℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘,则发生反应的化学方程式为3I2+6HCl+NaClO3=6ICl+NaCl+3H2O.
(3)设计实验证明:
①ICl的氧化性比I2强:用湿润的KI淀粉试纸检验一氯化碘蒸气,试纸变蓝.
②ICl与乙烯作用发生加成反应:在ICl(乙醇溶液)中通入乙烯,溶液褪色.
分析 (1)用干燥纯净的氯气与碘反应制备一氯化碘,A装置用二氧化锰和浓盐酸制备氯气,制得的氯气中含有HCl气体和水蒸气,先用饱和食盐水(C)除HCl气体,再用浓硫酸(E)干燥,将干燥的氯气通入B中与碘反应,制备ICl,而ICl挥发,所以B应放在冷水中,最后用氢氧化钠(D)处理未反应完的氯气,据此分析;
(2)粗碘和盐酸,控制温度约50℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘,根据氧化还原反应中化合价的升降相等可写;
(3)①根据氧化性强的物质制氧化性弱的物质分析;
②一氯化碘是一种红棕色液体,与乙烯发生加成反应,则颜色褪去.
解答 解:(1)用干燥纯净的氯气与碘反应制备一氯化碘,A装置用二氧化锰和浓盐酸制备氯气,制得的氯气中含有HCl气体和水蒸气,先用饱和食盐水(C)除HCl气体,再用浓硫酸(E)干燥,将干燥的氯气通入B中与碘反应,制备ICl,而ICl挥发,所以B应放在冷水中,最后用氢氧化钠(D)处理未反应完的氯气,
①则装置顺序为:A→C→E→B→D,A中发生反应的离子方程式为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:C→E→B→D;MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
②ICl挥发,所以B应放在冷水中,氢氧化钠(D)处理未反应完的氯气;
故答案为:防止ICl挥发;吸收未反应的氯气;
③已知:一氯化碘沸点101℃,则B装置得到的液态产物进一步蒸馏或蒸馏,收集101℃的馏分可得到较纯净的ICl;
故答案为:蒸馏,收集101℃的馏分;
(2)粗碘和盐酸,控制温度约50℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘,碘元素总共升2价,氯元素总共降6价,化合价升降应相等,则碘单质应配3,再由原子守恒可得:3I2+6HCl+NaClO3=6ICl+NaCl+3H2O;
故答案为:3I2+6HCl+NaClO3=6ICl+NaCl+3H2O;
(3)①根据氧化性强的物质制氧化性弱的物质,可用湿润的KI淀粉试纸检验一氯化碘蒸气,试纸变蓝;
故答案为:用湿润的KI淀粉试纸检验一氯化碘蒸气,试纸变蓝;
②一氯化碘是一种红棕色液体,不溶于水,溶于乙醇和乙酸,与乙烯发生加成反应,则颜色褪去;
故答案为:在ICl(乙醇溶液)中通入乙烯,溶液褪色.
点评 本题考查了物质的制备,涉及氧化还原反应、实验装置的选择、实验过程的控制,物质的分离提纯等知识点,为高考频点,题目难度中等,注意掌握物质性质灵活运用,善于提取题目的信息.

 智慧小复习系列答案
智慧小复习系列答案| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | 漂白粉使某些有机颜料褪色 | |
| B. | 一氧化氮气体在空气中变为红棕色 | |
| C. | 用二氧化硫漂白纸浆、毛、丝、草帽辫等 | |
| D. | 向红墨水中投入活性炭,红色褪去 |
| A. | 碳酸钠(发酵粉) | B. | Ca(ClO)2(消毒剂) | C. | Al2O3(耐火材料) | D. | 过氧化钠(供氧剂) |
(1)按物质的树状分类法填写表格的空白处:
| 分类标准 | 金属单质 | 氧化物 | 溶液 | 胶体 |
| 属于该类的物质 | ② | ⑧⑨ |
Ⅱ.(1)在 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 的反应中,氧化剂是KClO3,还原产物是HCl,氧化产物与还原产物的质量比是5:1.
(2)在反应MnO2+4HCl=MnCl2+Cl2↑+2H2O中,每生成标准状况下4.48LCl2,转移的电子的物质的量为0.4mol.
| A. | 英国道尔顿----提出元素概念 | |
| B. | 法国拉瓦锡----提出原子学说 | |
| C. | 汤姆生---发现电子 | |
| D. | 英国波义耳----建立燃烧现象的氧化学说 |