题目内容
14.研究硫元素及其化合物的性质具有重要意义.(1)硫离子的原子结构示意图为
 ,加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.
,加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O.(2)(NH4)2SO4是常用的化肥和化工原料,受热易分解,某兴趣小组拟探究其分解产物.
[查阅资料](NH4)2SO4在260℃~400℃时分解产物不同.
[实验探究]该小组拟选用如图所示装置进行实验(夹持和加热装置略)

实验1:连接装置A→B→C→D,检查气密性.按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2.品红溶液不褪色.取下装置B,加入指示利.用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00mL.经检验滴定后的溶液中无SO42-.
①仪器X的名称是圆底烧瓶.
②装置B内溶液吸收气体的物质的量是0.03mol.
实验2:连接装置A→D→B,检查气密性.按图示重新加入试剂;通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物.停止加热,冷却.停止通入N2,观察到装置A、D之间的导气管内有少量白色固体.经检验,该白色固体和装置D内溶液中有SO32-,无SO42-.进一步研究发现,气体产物中无氮氧化物.
③检查装置D内溶液中有SO32-无SO42-的实验操作和现象是取少许D溶液于试管中,加入足量BaCl2溶液,有白色沉淀生成,再加入盐酸,白色沉淀完全溶解,生成刺激性气味的气体,说明D内溶液中有SO32-,无SO42-.
④装置B内溶液吸收的气体是NH3.
⑤(NH4)2SO4在400℃分解的化学方程式是3(NH4)2SO4$\frac{\underline{\;400℃\;}}{\;}$4NH3↑+3SO2↑+6H2O↑+N2↑.
分析 (1)S是16号元素.S原子获得2个电子变为S2-,据此书写硫离子的结构示意图;加热时,硫元素的最高价氧化物对应水化物的浓溶液是浓硫酸与木炭反应生成二氧化碳、二氧化硫和水;
(2)实验1:①根据装置图可知仪器X为圆底烧瓶;
②根据消耗氢氧化钠计算B装置中剩余的HCl,参加反应的HCl吸收分解生成的NH3,发生反应:NH3+HCl=
NH4Cl,进而计算吸收NH3的物质的量,
实验2:③取D溶液于试管中,加入足量BaCl2溶液,再加入盐酸,白色沉淀完全溶解且生成刺激性气味的气体,说明D内溶液中有SO32-,无SO42-;
④装置D内溶液中有SO32-,说明分解生成SO2,装置A、D之间的导气管内有少量白色固体,白色固体应是二氧化硫、氨气与水形成的盐,装置B内溶液吸收的气体是氨气;
⑤由④中分析可知,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,配平书写方程式.
解答 解:(1)①S是16号元素.S原子获得2个电子变为S2-,硫离子的结构示意图为: ,加热时,硫元素的最高价氧化物对应水化物的浓溶液是浓硫酸与木炭反应生成二氧化碳、二氧化硫和水,反应的方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
,加热时,硫元素的最高价氧化物对应水化物的浓溶液是浓硫酸与木炭反应生成二氧化碳、二氧化硫和水,反应的方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O,
故答案为: ;C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
;C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2SO2↑+CO2↑+2H2O;
(2)①由仪器X的结构可知,X为圆底烧瓶,
故答案为:圆底烧瓶;
②滴定剩余盐酸,终点时消耗NaOH为0.025L×0.2mol/L=0.005mol,故剩余HCl为0.005mol,则参加反应的HCl为0.07L×0.5mol/L-0.005mol=0.03mol,参加反应的HCl吸收分解生成的NH3,发生反应:NH3+HCl=NH4Cl,故吸收NH3的物质的量为0.03mol,
故答案为:0.03;
③检查装置D内溶液中有SO32-,无SO42-的实验操作和现象是:取少许D溶液于试管中,加入足量BaCl2溶液,有白色沉淀生成,再加入盐酸,白色沉淀完全溶解,生成刺激性气味的气体,说明D内溶液中有SO32-,无SO42-,
故答案为:取少许D溶液于试管中,加入足量BaCl2溶液,有白色沉淀生成,再加入盐酸,白色沉淀完全溶解,生成刺激性气味的气体,说明D内溶液中有SO32-,无SO42-;
④装置D内溶液中有SO32-,说明分解生成SO2,装置A、D之间的导气管内有少量白色固体,白色固体应是二氧化硫、氨气与水形成的盐,装置B内溶液吸收的气体是氨气,
故答案为:NH3;
⑤由④中分析可知,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,分解反应方程式为:3(NH4)2SO4$\frac{\underline{\;400℃\;}}{\;}$4NH3↑+3SO2↑+6H2O↑+N2↑,
故答案为:3(NH4)2SO4$\frac{\underline{\;400℃\;}}{\;}$4NH3↑+3SO2↑+6H2O↑+N2↑.
点评 本题考查化学实验,涉及化学仪器、滴定操作、实验方案设计、化学计算、物质推断、化学方程式书写等,是对学生综合能力的考查,较好的考查学生分析推理能力、知识迁移运用能力难度中等.

 阅读快车系列答案
阅读快车系列答案| t/min | 1 | 2 | 3 | 4 |
| c(N2O5)/mol.L-1 | 0.133 | 0.080 | 0.057 | 0.040 |
| v正/mol.L-1.min-1 | 0.0466 | 0.028 | 0.020 | 0.014 |
| A. | 340K时,速率表达式中m=1 | |
| B. | 340K时,速率表达式中k正≈0.35min-1 | |
| C. | 340K时,若c(N2O3)=0.100mol.L-1,则v正≈0.035mol.L-1.min-1 | |
| D. | 若t=2min时升高温度,则m不变,k正减小 |
| A. | 化学反应中的能量变化都表现为热量变化 | |
| B. | 需要加热才能发生的反应不一定是吸热反应 | |
| C. | 任何化学反应过程中都伴随有能量的变化 | |
| D. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
| A. | 在常温常压下,11.2 L 氯化氢气体含有的分子数为0.5 NA | |
| B. | 1.7g 氨气(NH3)所含原子数目为 0.4NA | |
| C. | 同温同压时,相同体积的任何气体单质所含的原子数相同 | |
| D. | 1 L 1 mol•L-1的Na2SO4溶液中含粒子的总数为3NA |
| A. | Na+、Ba2+、NO3-、Cl- | B. | H+、Mg2+、Na+、SO42- | ||
| C. | CO32-、K+、Cl-、Na+ | D. | Fe2+、NO3-、SO42-、Na+ |

| A. | 分子式为C26H28O6N | |
| B. | 遇FeCl3溶液不能发生显色反应 | |
| C. | 1mol该物质最多能与8mol氢气发生加成反应 | |
| D. | 1mol该物质最多能与4molNaOH溶液完全反应 |
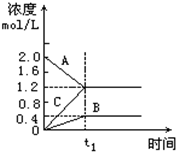 如图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间,t1为2分钟.试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间,t1为2分钟.试回答: