题目内容
下列溶液中各离子的浓度关系不正确的是( )
| A、0.1mol?L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol?L-1 |
| B、浓度均为0.1 mol?L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中:c(CO32-)+c(OH-)=c(H+)+c(H2CO3) |
| C、25℃时,pH=9.4、浓度均为0.1 mol?L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) |
| D、3.0L 0.1mol?L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
B.二者恰好反应生成浓度均为0.05mol/LNaHCO3和NaCl,根据电荷守恒和物料守恒判断;
C.25℃时,pH=9.4、浓度均为0.1 mol?L-1的HCN与NaCN的混合溶液,CN-的水解程度大于电离程度;
D.n(NaOH)=0.1mol/L×3.0L=0.3mol,n(CO2)=
=0.2mol,1<
=1.5<2,所以二者反应生成NaHCO3和Na2CO3,设n(Na2CO3)=xmol、n(NaHCO3)=ymol,根据C原子、Na原子守恒得
解得
,所以二者反应生成等物质的量的NaHCO3和Na2CO3,碳酸钠的水解程度远远大于碳酸氢钠的水解程度.
B.二者恰好反应生成浓度均为0.05mol/LNaHCO3和NaCl,根据电荷守恒和物料守恒判断;
C.25℃时,pH=9.4、浓度均为0.1 mol?L-1的HCN与NaCN的混合溶液,CN-的水解程度大于电离程度;
D.n(NaOH)=0.1mol/L×3.0L=0.3mol,n(CO2)=
| 8.8g |
| 44g/mol |
| n(NaOH) |
| n(CO2) |
|
|
解答:
解:A.任何电解质溶液中都存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=0.1mol?L-1,故A正确;
B.二者恰好反应生成浓度均为0.05mol/LNaHCO3和NaCl,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),根据物料守恒得c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3)=2c(Cl-),所以得c(CO32-)+c(OH-)=c(H+)+c(H2CO3),故B正确;
C.25℃时,pH=9.4、浓度均为0.1 mol?L-1的HCN与NaCN的混合溶液,CN-的水解程度大于电离程度,则c(CN-)<c(HCN),故C错误;
D.n(NaOH)=0.1mol/L×3.0L=0.3mol,n(CO2)=
=0.2mol,1<
=1.5<2,所以二者反应生成NaHCO3和Na2CO3,设n(Na2CO3)=xmol、n(NaHCO3)=ymol,
根据C原子、Na原子守恒得
解得
,所以二者反应生成等物质的量的NaHCO3和Na2CO3,碳酸钠的水解程度远远大于碳酸氢钠的水解程度,所以溶液中c(CO32-)<c(HCO3-),故D错误;
故选CD.
B.二者恰好反应生成浓度均为0.05mol/LNaHCO3和NaCl,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),根据物料守恒得c(Na+)=2c(HCO3-)+2c(CO32-)+2c(H2CO3)=2c(Cl-),所以得c(CO32-)+c(OH-)=c(H+)+c(H2CO3),故B正确;
C.25℃时,pH=9.4、浓度均为0.1 mol?L-1的HCN与NaCN的混合溶液,CN-的水解程度大于电离程度,则c(CN-)<c(HCN),故C错误;
D.n(NaOH)=0.1mol/L×3.0L=0.3mol,n(CO2)=
| 8.8g |
| 44g/mol |
| n(NaOH) |
| n(CO2) |
根据C原子、Na原子守恒得
|
|
故选CD.
点评:本题考查了离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,再结合物料守恒、电荷守恒来分析解答,难点是D选项,先根据守恒确定溶液中的溶质,再根据水解程度大小确定离子浓度,题目难度中等.

练习册系列答案
相关题目
咖啡酸具有止血、镇咳、祛痰等疗效,其结构简式为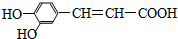 .有关咖啡酸的说法中不正确的是( )
.有关咖啡酸的说法中不正确的是( )
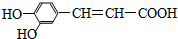 .有关咖啡酸的说法中不正确的是( )
.有关咖啡酸的说法中不正确的是( )| A、咖啡酸可以发生还原、取代、加聚等反应 |
| B、咖啡酸与FeCl3溶液可以发生显色反应 |
| C、1 mol咖啡酸可与4 mol H2发生加成反应 |
| D、1 mol咖啡酸最多能消耗3 mol的NaHCO3 |
下列说法正确的是( )
| A、检验氯乙烷中的氯元素时,将氯乙烷和NaOH溶液混合加热后,先用稀硫酸进行酸化,再加人AgN03溶液进行检验 |
| B、为了加快过滤速度以及得到较干燥的硅酸白色胶状沉淀可以采用抽滤的方法 |
| C、通常采用产生气泡的快慢,来比较不同条件下Na2S2O3溶液与稀硫酸的反应速率 |
| D、银氨溶液不能留存,久置后会变成氮化银,容易爆炸 |
等体积等物质的量浓度的四种溶液:①(NH4)2SO4溶液②NH4Cl溶液③CH3COONH4溶液④(NH4)2Fe(SO4)2溶液,下列有关四种溶液的说法正确的是( )
| A、常温下,测得③溶液的pH=7,说明该溶液中的CH3COO-与NH4+没有发生水解 |
| B、这四种溶液中c(NH4+)大小顺序为:④>①>③>② |
| C、向②溶液中加一定量的浓氨水,可能会出现:c(NH4+)═c(Cl-) |
| D、向盛有少量苯酚溶液的试管中滴加几滴④溶液,可以看到溶液呈紫色 |
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是( )
| A、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) |
| B、0.1 mol?L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
| C、0.1 mol?L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO32-) |
| D、0.01 mol?L-1 NaOH溶液与等体积pH=2的醋酸混合后的溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
下列说法正确的是( )
| A、在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小 |
| B、反应Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)在常温下不能自发进行,则△H<0 |
| C、工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 |
| D、在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
向NaOH(aq)滴入HCOOH(aq)的过程中,所得到的混合溶液中离子浓度的大小关系可能正确的是( )
| A、c(OH-)=c(Na+)>c(HCOO-)>c(H+) |
| B、c(Na+)=c(HCOO-) |
| C、c(Na+)>c(HCOO-)>c(OH-)>c(H+) |
| D、c(H+)>c(HCOO-)>c(Na+)>c(OH-) |