题目内容
一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如右图所示.以下说法不正确的是( )


| A、中间室Cl-移向左室 |
| B、X气体为CO2 |
| C、处理后的含硝酸根废水pH降低 |
| D、电路中每通过1 mol电子,产生标准状况下氮气的体积为2.24L |
考点:化学电源新型电池
专题:
分析:该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极是负极,负极上有机物失电子发生氧化反应生成X,有机物在厌氧菌作用下生成二氧化碳,据此分析解答.
解答:
解:该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极是正极,电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,左边装置电极是负极,负极上有机物失电子发生氧化反应生成X,有机物在厌氧菌作用下生成二氧化碳,
A.放电时,电解质溶液中阴离子Cl-移向负极室左室,故A正确;
B.有机物在厌氧菌作用下生成二氧化碳,所以X气体为CO2,故B正确;
C.正极电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,氢离子参加反应导致溶液酸性减小,溶液的pH增大,故C错误;
D.根据2NO3-+10e-+12H+=N2↑+6H2O知,电路中每通过1 mol电子,产生标准状况下氮气的体积=
×22.4L/mol=2.24L,故D正确;
故选C.
A.放电时,电解质溶液中阴离子Cl-移向负极室左室,故A正确;
B.有机物在厌氧菌作用下生成二氧化碳,所以X气体为CO2,故B正确;
C.正极电极反应式为2NO3-+10e-+12H+=N2↑+6H2O,氢离子参加反应导致溶液酸性减小,溶液的pH增大,故C错误;
D.根据2NO3-+10e-+12H+=N2↑+6H2O知,电路中每通过1 mol电子,产生标准状况下氮气的体积=
| 1mol |
| 10 |
故选C.
点评:本题考查化学电源新型电池,侧重考查学生获取信息、分析推断能力,根据N元素化合价变化确定正负极,难点是电极反应式的书写,且原电池和电解池原理是高考高频点,要熟练掌握.

练习册系列答案
 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
下列说法正确的是( )
| A、SiO2既能和HF反应,又能和NaOH溶液反应,属于两性氧化物 |
| B、石英具有很好的导电性能,可用于生产光导纤维 |
| C、“地沟油”经过加工处理后,可以用来制造肥皂和生物柴油 |
| D、酯在碱性条件下的水解反应叫皂化反应 |
探究浓硫酸和铜的反应,下列装置或操作正确的是( )
A、 用装置进行铜和浓硫酸的反应 |
B、 用装置收集二氧化硫并吸收尾气 |
C、 用装置稀释反应后的混合液 |
D、 用装置测定余酸的浓度 |
某强酸性溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:下列有关推断合理的是( )


| A、根据上述连续实验不能确定溶液X中是否含有Fe3+ |
| B、沉淀H为Al(OH)3、BaCO3的混合物 |
| C、溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- |
| D、若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.05 mol?L-1 |
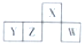 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,且4种元素最外层电子数之和与Ca2+的核外电子数相等.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,且4种元素最外层电子数之和与Ca2+的核外电子数相等.下列判断正确的是( )| A、元素X、Z的原子半径大小:X>Z |
| B、含Y元素的盐溶液有的显酸性,有的显碱性 |
| C、Y、W的简单氢化物中氢元素的化合价相同 |
| D、钙与W可以形成CaW2化合物,且化合物中含有离子键 |
 ,经测定,C谱有四个峰,其数值高低比例为2:1:1:1;H谱有四个峰,其数值高低比例为1:2:3:6,有机物A碳谱有两个峰,峰高比为4:1,氢谱有一个峰,试写出有机物A的结构简式
,经测定,C谱有四个峰,其数值高低比例为2:1:1:1;H谱有四个峰,其数值高低比例为1:2:3:6,有机物A碳谱有两个峰,峰高比为4:1,氢谱有一个峰,试写出有机物A的结构简式