题目内容
2.与NH2-具有相同的质子数和电子数的微粒是( )| A. | OH- | B. | NH4+ | C. | H3O+ | D. | CH4 |
分析 不带电荷的微粒中质子数等于电子数,阳离子中质子数=电子数+电荷数,阴离子中质子数=电子数-电荷数;NH2-具有9个质子,10个电子.
解答 解:A、一个OH-中有9个质子和10个电子,和NH2-的质子数和电子数相同,故A正确;
B、一个NH4+中含有11个质子和10的电子,和NH2-的质子数不同,故B错误;
C、一个H3O+中含有11个质子和10的电子,和NH2-的质子数不同,故C错误;
D、一个CH4中含有10个质子和10个电子,和NH2-的质子数不同,故D错误;
故选A.
点评 本题考查微粒的质子数和电子数,明确原子序数与质子数、电子数的关系即可解答,难度不大.

练习册系列答案
 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
12.化学与社会、生活、生产密切相关.对如表现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 用明矾净水 | 明矾具有杀菌消毒的作用 |
| B | 局部地区出现酸雨 | 煤、石油的燃烧产生大量CO2 |
| C | 潮湿环境中的铁制品生锈 | 铁制品中的Fe与空气中的O2直接反应生成Fe2O3 |
| D | “84”消毒液具有漂白性 | “84”消毒液中的NaClO与空气中的CO2反应生成HClO |
| A. | A | B. | B | C. | C | D. | D |
13.下列事实不能用勒夏特列原理解释的是( )
| A. | 合成氨工厂采用增大压强以提高原料的转化率 | |
| B. | 实验室用排饱和食盐水法收集氯气 | |
| C. | 打开汽水瓶有气泡从溶液中冒出 | |
| D. | 2NO2(g)═N2O4(g)的平衡体系中,加压缩小体积后颜色加深用来表示可逆反应 |
10. ⅥA 元素的各种性质可归纳整理如下:
ⅥA 元素的各种性质可归纳整理如下:
回答下列问题:
(1)碲(Te)的氧化物分子式是TeO2、TeO3.
(2)硒酸与碲酸酸性较强的是H2SeO4(填化学式).
(3)比较键能:H-S>H-Se(填“>”或“<”).
(4)氢硒酸放在空气中,可能发生反应的化学方程式为2H2Se+O2=2H2O+2Se↓.
(5)如图所示为ⅥA 族元素单质与 H2反应过程中体系温度变化示意图,其中 a、b、c 分别表示 VIA 族中某一元素的单质,如图为相同物质的量的单质与 H2反应过程中的体系温度变化.则:c 代表硒.(均写单质名称)
 ⅥA 元素的各种性质可归纳整理如下:
ⅥA 元素的各种性质可归纳整理如下:| 性质 | 8O | 16S | 34Se | 52Te |
| 单质熔点/℃ | -218.4 | 113 | 271 | 450 |
| 单质沸点/℃ | -183 | 444.6 | 685 | 1390 |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
(1)碲(Te)的氧化物分子式是TeO2、TeO3.
(2)硒酸与碲酸酸性较强的是H2SeO4(填化学式).
(3)比较键能:H-S>H-Se(填“>”或“<”).
(4)氢硒酸放在空气中,可能发生反应的化学方程式为2H2Se+O2=2H2O+2Se↓.
(5)如图所示为ⅥA 族元素单质与 H2反应过程中体系温度变化示意图,其中 a、b、c 分别表示 VIA 族中某一元素的单质,如图为相同物质的量的单质与 H2反应过程中的体系温度变化.则:c 代表硒.(均写单质名称)
17.己知N2(g)+3H2(g)?2NH3(g)△H<0.图是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线.
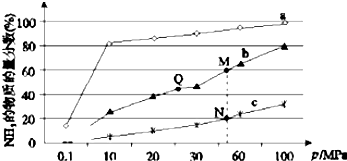
关于工业合成氨的反应,下列叙述不正确的是( )

关于工业合成氨的反应,下列叙述不正确的是( )
| A. | 上图中M、N、Q点平衡常数K 的大小关系为K(M)=K(Q)>K(N) | |
| B. | 加催化剂能加快反应速率但H2的平衡转化率不变 | |
| C. | 相同压强条件下,投料相同,达到平衡所需时间关系为a>b>c | |
| D. | 由曲线a可知,当压强增加到10OMPa以上,NH3的物质的量分数可达到100% |
7.对于可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | NH3和H2O化学反应速率关系是2v正(NH3)=3v正(H2O) | |
| B. | 达到化学平衡时,4v正(O2)=5v逆(NO) | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 | |
| D. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
14.已知49%(溶质的质量分数)的硫酸溶液的浓度为amol•L-1,试判断98%硫酸溶液的浓度为( )
| A. | 大于2amol•L-1 | B. | 等于2amol•L-1 | C. | 小于2amol•L-1 | D. | 无法判断 |
6.根据所学实验知识,完成下列空白.
(Ⅰ)图中三套的装置均能用于探讨化学反应中热量变化

(1)装置1适用于探究明显吸热的反应,例如2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O(用化学方程式表示),反应过程中断裂的化学键有AB(填选项)
A.离子键 B.极性共价键 C.非极性共价键
(2)装置2既适用于放热反应(或过程)的探究,也适用于吸热反应(或过程)的探究.若在装置2中完成金属铝与NaOH溶液的反应,则右侧U形管内的液面C(填选项)
A.两边一样高 B.左高右低 C.右高左低 D.高低不确定
(3)装置3可用于定量测定中和热,其中a仪器的名称为环形玻璃搅拌棒,通过实验获得如下数据,则中和热△H=-56.8kJ•mol-1(计算结果保留一位小数)
(已知t1为NaOH和HCl起始温度平均值,t2为终止温度.反应后溶液的比热容C为4.18kJ•℃-1•Kg-1,各溶液的密度均为1g•cm-3.).下列关于该实验的说法正确的是AF.
A.该实验中酸碱的浓度不宜太大也不宜太小
B.可以用铜丝代替a仪器
C.量取酸溶液时视线俯视,将使测得的中和热的数值偏高
D.其他条件不变,将酸溶液体积调整为40ml,将使测得的中和热的数值偏高
E.向盛装酸的烧杯中加碱时要小心缓慢
F.测了酸后的温度计要用水清洗后再测碱的温度.
(Ⅰ)图中三套的装置均能用于探讨化学反应中热量变化

(1)装置1适用于探究明显吸热的反应,例如2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O(用化学方程式表示),反应过程中断裂的化学键有AB(填选项)
A.离子键 B.极性共价键 C.非极性共价键
(2)装置2既适用于放热反应(或过程)的探究,也适用于吸热反应(或过程)的探究.若在装置2中完成金属铝与NaOH溶液的反应,则右侧U形管内的液面C(填选项)
A.两边一样高 B.左高右低 C.右高左低 D.高低不确定
(3)装置3可用于定量测定中和热,其中a仪器的名称为环形玻璃搅拌棒,通过实验获得如下数据,则中和热△H=-56.8kJ•mol-1(计算结果保留一位小数)
| 实验试剂及用量 | 溶液温度 | |||
| t1 | t2 | |||
| ① | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.3℃ |
| ② | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 23.5℃ |
| ③ | 50mL0.55mol•L-1NaOH | 50mL.0.5mol•L-1HCl | 20℃ | 24.5℃ |
A.该实验中酸碱的浓度不宜太大也不宜太小
B.可以用铜丝代替a仪器
C.量取酸溶液时视线俯视,将使测得的中和热的数值偏高
D.其他条件不变,将酸溶液体积调整为40ml,将使测得的中和热的数值偏高
E.向盛装酸的烧杯中加碱时要小心缓慢
F.测了酸后的温度计要用水清洗后再测碱的温度.