题目内容
6.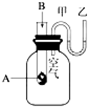 为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:
为了研究化学反应A+B═C+D的能量变化情况,某同学设计了如图所示装置.当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升.试回答下列问题:(1)该反应为放热反应(填“放热”或“吸热”).
(2)A和B的总能量比C和D的总能量高(填“高”或“低”).
(3)物质中的化学能通过化学反应转化成热能释放出来.
(4)反应物化学键断裂吸收的能量低(填“高”或“低”)于生成物化学键形成放出的能量.
(5)写出一个符合题中条件的化学方程式:2Al+6HCl=AlCl3+3H2↑
Ⅱ.已知:P4(白磷,s)+5O2(g)═P4O10(s)△H=-2 983.2kJ•mol-1 ①
P(红磷,s)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H=-738.5kJ•mol-1 ②
则白磷转化为红磷的热化学方程式为P4(白磷,s)=4P(红磷,s)△H=-29.2kJ/mol.相同状况下,能量状态较低的是红磷;白磷的稳定性比红磷低(填“高”或“低”).
分析 Ⅰ.当向盛有A的试管中滴加试剂B时,看到U型管中甲处液面下降乙处液面上升,根据气体具有热胀冷缩的性质,可以判断反应的吸放热情况,根据反应物和生成物能量之间的关系与反应的吸放热之间的关系以及化学键断裂和生成过程的能量变化进行回答;
Ⅱ.P4(s,白磷)+5O2(g)=P4O10(s)△H1=-2983.2kJ/mol…①
P(红磷,s)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H=-738.5kJ•mol-1 ②
根据盖斯定律:①-②×4可得:P4(s,白磷)=4P(s,红磷),据此计算出该反应的焓变,然后书写热化学方程式;根据物质的总能量与反应热的关系判断,能量越高物质越稳定.
解答 解:Ⅰ.(1)由于发生反应A+B═C+D,U型管中甲处液面下降乙处液面上升,根据气体具有热胀冷缩的性质可以判断该反应为放热反应,
故答案为:放热;
(2)由于A+B═C+D的反应为吸热反应,所以A和B的总能量比C和D的总能量高,
故答案为:高;
(3)化学变化伴随着物质和能量变化,物质中的化学能通过化学反应转化成热能释放出来,
故答案为:热能;
(4)化学反应中旧键断裂吸收能量,新键生成放出能量,该反应为吸热反应,则反应物化学键断裂吸收的能量低于生成物化学键形成放出的能量,
故答案为:低;
(5)该反应为放热反应,且不需要加热既能够发生,如铝与稀盐酸的反应为放热反应,该反应的化学方程式为:2Al+6HCl=AlCl3+3H2↑,
故答案为:2Al+6HCl=AlCl3+3H2↑;
Ⅱ.P4(s,白磷)+5O2(g)=P4O10(s)△H1=-2983.2kJ/mol…①
P(红磷,s)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H=-738.5kJ•mol-1 ②
根据盖斯定律①-②×4可得:P4(s,白磷)=4P(s,红磷)△H=(-2983.2kJ/mol)-(-738.5kJ)×4=-29.2kJ/mol,
说明白磷转化为红磷是放热反应,相同的状况下,能量比白磷低,由于能量越低物质越稳定,则白磷的稳定性比红磷低,
故答案为:P4(白磷,s)=4 P(红磷,s)△H=-29.2 kJ/mol;红磷;低.
点评 本题考查了反应热与焓变的综合应用,题目难度中等,明确化学反应与能量变化的关系为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的分析能力及灵活应用基础知识的能力.

| A. |  滴加药品的使用 | B. |  移走加热的蒸发皿 | ||
| C. |  液体药品的取用 | D. |  稀释浓硫酸 |
| A. | 一定温度下,1 L 0.50 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1 NH4Cl溶液含NH+4物质的量不同 | |
| B. | 1L1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 | |
| D. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子. |
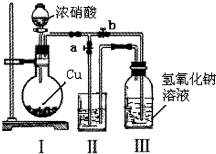 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:


