题目内容
13.在pH均为3的醋酸溶液和稀硫酸中,下列叙述中,相等的是( )①物质的量浓度
②氢离子浓度
③与足量锌反应时的初始速率
④电离程度
⑤中和等体积的两种酸所需同浓度氢氧化钠溶液的体积
⑥稀释相同倍数后的pH.
| A. | ①④ | B. | ②③ | C. | ②④⑥ | D. | ②⑤ |
分析 pH均为3的醋酸溶液和稀硫酸中,氢离子浓度一样,对水的抑制程度一样,但是醋酸是弱酸,加水会促进电离,所以加水稀释等体积倍数后,醋酸的酸性会强于硫酸,和金属锌反应的速率和氢离子浓度大小有关,和氢氧化钠反应,消耗同浓度氢氧化钠溶液的体积和酸的浓度大小有关系.
解答 解:pH均为3的醋酸溶液和稀硫酸中,氢离子浓度一样,醋酸是弱酸,加水会促进电离.
①物质的量浓度:醋酸的大于硫酸,故错误;
②pH均为3,氢离子浓度一样,故正确;
③pH均为3,氢离子浓度一样,与足量锌反应时的初始速率相等,故正确;
④电离程度不同,强酸完全电离,弱酸部分电离,故错误;
⑤pH均为3的醋酸溶液和稀硫酸中,醋酸浓度大,中和等体积的两种酸,所需同浓度氢氧化钠溶液的体积:醋酸的多,故错误;
⑥醋酸是弱酸,加水会促进电离,所以加水稀释等体积倍数后,醋酸的酸性会强于硫酸,即稀释相同倍数后的pH不同,故错误.
故选B.
点评 本题考查学生弱电解质的电离、影响反应速率的因素以及pH的有关计算等知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
3.对于下列反应,其中葡萄糖不能发生的是( )
| A. | 酯化 | B. | 氧化 | C. | 加成 | D. | 水解 |
4.漂白液的有效成分是( )
| A. | NaCl | B. | NaClO | C. | NaOH |
1.Na2S2O3•5H2O是重要的化工原料.取126.0g Na2SO3,溶于800mL水配成溶液.另取一定量的硫粉加乙醇后和上述溶液混合.小火加热至微沸,反应约1h后过滤.滤液经蒸发、浓缩、冷却至10℃后析出Na2S2O3•5H2O粗晶体.
(1)加入乙醇的目的是加大Na2SO3和硫粉的接触面积,加快反应速率.
(2)若将126.0g Na2SO3反应完全,理论上需要硫粉的质量为32.0g.
(3)滤液中除Na2S2O3和未反应的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(4)为测定所得粗晶体中Na2S2O3•5H2O和Na2SO3比例,现称取三份质量不同的粗晶体,分别加入相同浓度的硫酸溶液30mL,充分反应(Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O)后滤出硫,微热滤液使SO2全部逸出.测得有关实验数据如下表(气体体积已换算为标准状况).
求所用硫酸溶液的物质的量浓度及粗晶体中n(Na2S2O3•5H2O)、n(Na2SO3)的比值.(请写出计算过程).
(1)加入乙醇的目的是加大Na2SO3和硫粉的接触面积,加快反应速率.
(2)若将126.0g Na2SO3反应完全,理论上需要硫粉的质量为32.0g.
(3)滤液中除Na2S2O3和未反应的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(4)为测定所得粗晶体中Na2S2O3•5H2O和Na2SO3比例,现称取三份质量不同的粗晶体,分别加入相同浓度的硫酸溶液30mL,充分反应(Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O)后滤出硫,微热滤液使SO2全部逸出.测得有关实验数据如下表(气体体积已换算为标准状况).
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 6.830 | 13.660 | 30.000 |
| 二氧化硫气体的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.800 | 1.600 | 3.200 |
18.下列实验操作正确且从安全角度考虑的是( )
①点燃乙炔前,应先检验乙炔纯度
②处理含氨气的尾气,可将导管直接通入盛稀盐酸的烧杯里
③给烧瓶中的液体加热时应加入碎瓷片
④在氯化氢气体中灼烧氯化镁晶体制得无水氯化镁
⑤配制酒精与浓硫酸混合液:先向烧杯里注入酒精,后注入浓硫酸,并不断搅拌
⑥为了便于观察,将钠块放入装有水的试管里反应,并塞紧塞子.
①点燃乙炔前,应先检验乙炔纯度
②处理含氨气的尾气,可将导管直接通入盛稀盐酸的烧杯里
③给烧瓶中的液体加热时应加入碎瓷片
④在氯化氢气体中灼烧氯化镁晶体制得无水氯化镁
⑤配制酒精与浓硫酸混合液:先向烧杯里注入酒精,后注入浓硫酸,并不断搅拌
⑥为了便于观察,将钠块放入装有水的试管里反应,并塞紧塞子.
| A. | ①②④ | B. | ①③⑤ | C. | ③④⑥ | D. | ③⑤⑥ |
2.硅及其化合物已被广泛用于生产生活中,下列说法中错误的是( )


| A. | 右图是常见于汽车中的小摆件“苹果花”,它的动力是以Si为原料制作的太阳能电池 | |
| B. | 玻璃上的精美刻花,是工艺师用盐酸刻蚀玻璃形成的 | |
| C. | 互联网通过光纤交换信息,光纤的主要原料是SiO2 | |
| D. | 因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 |
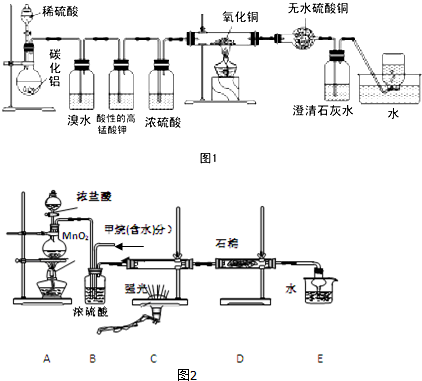
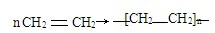 .
.