题目内容
5.利用所学化学知识解答问题:(1)潜水员乘坐的潜水钟以钢铁为主要制造材料.钢铁容易在潮湿空气中发生电化学腐蚀,其负极的电极反应式是Fe-2e-=Fe2+.
(2)随便丢弃用过的聚乙烯塑料膜会造成白色污染,写出由乙烯在催化剂作用下制备聚乙烯的化学方程式
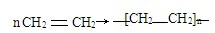 .
.
分析 (1)钢铁容易在潮湿空气中发生电化学腐蚀,Fe作负极,失去电子发生氧化反应;
(2)乙烯含有碳碳双键,可发生加聚反应生成聚乙烯.
解答 解:(1)钢铁容易在潮湿空气中发生电化学腐蚀,Fe作负极,失去电子发生氧化反应,其负极的电极反应式是Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
(2)聚乙烯塑料可用来包装食品,CH2=CH2含有C=C,可发生加聚反应,反应的方程式为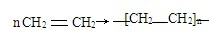 ,
,
故答案为: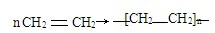 .
.
点评 本题考查了金属的腐蚀、有机化学方程式书写,明确原电池工作原理、熟悉乙烯结构是解题关键,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
15.下列离子方程式正确的是( )
| A. | 稀硫酸与氢氧化镁反应H++OH-=H2O | |
| B. | 铁与稀硝酸反应Fe+2H+=Fe2++H2↑ | |
| C. | 三氯化铁溶液与氨水反应Fe3++3OH-=Fe(OH)3↓ | |
| D. | 过量二氧化碳与石灰水反应 CO2+OH一=HCO3- |
13.在pH均为3的醋酸溶液和稀硫酸中,下列叙述中,相等的是( )
①物质的量浓度
②氢离子浓度
③与足量锌反应时的初始速率
④电离程度
⑤中和等体积的两种酸所需同浓度氢氧化钠溶液的体积
⑥稀释相同倍数后的pH.
①物质的量浓度
②氢离子浓度
③与足量锌反应时的初始速率
④电离程度
⑤中和等体积的两种酸所需同浓度氢氧化钠溶液的体积
⑥稀释相同倍数后的pH.
| A. | ①④ | B. | ②③ | C. | ②④⑥ | D. | ②⑤ |
20.下列四幅谱图是结构简式为CH3CH2OH、CH3OCH3、CH3CH2CH2OH和(CH3)3COH的四种有机物的核磁共振氢谱.其中属于CH3CH2CH2OH的核磁共振氢谱图的是( )
| A. |  | B. | 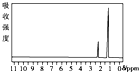 | C. | 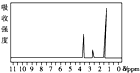 | D. |  |
10.下列叙述中正确的是( )
| A. | 1 mol Na2O2与CO2完全反应时转移电子数为2NA | |
| B. | 标准状况下11.2 L Cl2与4.25 g NH3所含有的原子数 | |
| C. | 标准状况下36 g H2O与1.204×1024个O2分子所占的体积 | |
| D. | 1mol固体NaHCO3所含有的阴阳离子总数为3NA |
17.下列过程或现象与盐类水解无关的是( )
| A. | 用热的纯碱溶液去油污 | |
| B. | pH=3的醋酸溶液,加水稀释10倍后pH<4 | |
| C. | 实验室配置FeCl3溶液时,加入少量稀盐酸,以防止溶液浑浊 | |
| D. | 草木灰与铵态氮肥不能混合施用 |
14. 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:
(1)将浓度为0.1mol•L-1 HF溶液加水稀释一倍(假设温度不变),下列各量增大的是CD.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c({H}^{+})}{c(HF)}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
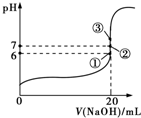
(2)25℃时,在20mL 0.1mol•L-1氢氟酸中加入V mL 0.1mol•L-1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F-)-c(Na+)=9.9×10-7 mol•L-1
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol•L-1
(3)物质的量浓度均为0.1mol•L-1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液.依据数据判断pH由大到小的顺序是①④②③(或①>④>②>③,用物质名称表示也对),.
(4)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验事实证明之在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅.
(5)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1mol HF转移2mol电子.
 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:
电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:| 化学式 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c({H}^{+})}{c(HF)}$ D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)25℃时,在20mL 0.1mol•L-1氢氟酸中加入V mL 0.1mol•L-1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是BC.
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中c(F-)-c(Na+)=9.9×10-7 mol•L-1
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol•L-1
(3)物质的量浓度均为0.1mol•L-1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液.依据数据判断pH由大到小的顺序是①④②③(或①>④>②>③,用物质名称表示也对),.
(4)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验事实证明之在碳酸钠溶液中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去或变浅.
(5)长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F.HFO与水反应得到HF和化合物A,每生成1mol HF转移2mol电子.
15.某有机化合物的结构简式如图所示.下列说法正确的是( )


| A. | 不能发生银镜发应 | |
| B. | 1mol 该物质最多可与2molBr2反应 | |
| C. | 与NaHCO3、Na2CO3均能发生反应 | |
| D. | 1mol 该物质最多可与4mol NaOH反应 |