题目内容
5.工业合成氨可以实现大规模固氮,氨可用于生产氯化铵、硫酸铵等化学肥料.(1)等物质的量浓度的两溶液,pH大小为:氯化铵>硫酸铵(选填>、=或<,下同);铵根离子浓度相同的两溶液,两者的浓度大小关系为:氯化铵>硫酸铵;
(2)检验铵态氮肥中铵根离子的实验方案是取样,加入试管配成溶液,加入浓氢氧化钠溶液,加热,在试管口放一片湿润的红色石蕊试纸,若变蓝,则含有铵根离子;反之没有;
(3)长期施用硫酸铵,土壤会酸化板结的原因是硫酸铵是强酸弱碱盐,其溶液呈酸性,所以长期施用,土壤会酸化板结.
最新“人工固氮”的研究报道:常温常压、催化剂条件下,N2与水发生反应:2N2(g)+6H2O(l)?4NH3 (g)+3O2(g)?Q,(Q>0).
(4)如果反应的平衡常数K值变小,该反应正反应速率减小(选填增大、减小或不变,下同),逆反应速率减小.
(5)请用上述反应中的有关物理量来说明该反应已达到平衡状态容器中气体的总质量不随时间而变化或容器中气体的平均相对分子质量不随时间而变化或容器中气体的密度不随时间而变化或v正(N2):v逆(O2)=2:3.
(6)若反应的容器容积为2.0L,反应时间4.0min,容器内气体的密度增大了0.18g/L,在这段时间内O2的平均反应速率为0.00125mol•L-1min-1.
分析 (1)等物质的量浓度的氯化铵和硫酸铵,铵根离子浓度硫酸铵大溶液PH小,若铵根离子浓度相同则硫酸铵溶液浓度小;
(2)依据铵根离子和氢氧根离子结合生成一水合氨,加热分解生成的氨气能使湿润的红色石蕊试纸变蓝设计证明;
(3)长期施用硫酸铵能够使土壤中的氢离子浓度升高;
(4)2N2(g)+6H2O(l)?4NH3 (g)+3O2(g)?Q,(Q>0),反应是吸热反应,如果反应的平衡常数K值变小说明平衡逆向进行,温度降低,反应速率减小;
(5)反应达到平衡的标志是正逆反应速率相同,各组分含量保持不变分析,由此分析解答;
(6)容器内气体的密度增大了0.18g/L,即水的质量减少了0.18g/L×2L=0.36g,则生成氧气物质的量为:$\frac{1}{2}$×$\frac{0.36g}{18g/mol}$=0.01mol,再据v=$\frac{\frac{△n}{V}}{△t}$计算速率.
解答 解:(1)等物质的量浓度的两溶液,氯化铵含一个铵根,硫酸铵含两个铵根,pH大小为:氯化铵>硫酸铵,铵根离子浓度相同的两溶液,两者的浓度大小关系为:氯化铵>硫酸铵,
故答案为:>;>;
(2)检验铵态氮肥中铵根离子的实验方案是:取样,加入试管配成溶液,加入浓氢氧化钠溶液,加热,在试管口放一片湿润的红色石蕊试纸,若变蓝,则含有铵根离子;反之没有,
故答案为:取样,加入试管配成溶液,加入浓氢氧化钠溶液,加热,在试管口放一片湿润的红色石蕊试纸,若变蓝,则含有铵根离子;反之没有;
(3)长期施用硫酸铵会使土壤板结酸化,硫酸铵是强酸弱碱盐,其溶液呈酸性,所以长期施用,土壤会酸化板结,
故答案为:硫酸铵是强酸弱碱盐,其溶液呈酸性,所以长期施用,土壤会酸化板结;
(4)2N2(g)+6H2O(l)?4NH3 (g)+3O2(g)?Q,(Q>0),反应是吸热反应,如果反应的平衡常数K值变小说明平衡逆向进行,温度降低,反应速率减小,在内反应速率减小,该反应正反应速率减小,逆反应速率减小,
故答案为:减小; 减小;
(5)2N2(g)+6H2O(l)?4NH3 (g)+3O2(g)?Q,(Q>0),反应是气体体积增大的吸热反应,容器中气体的总质量不随时间而变化或容器中气体的平均相对分子质量不随时间而变化或容器中气体的密度不随时间而变化或v正(N2):v逆(O2)=2:3时,在内反应速率相同说明反应达到平衡状态,
故答案为:容器中气体的总质量不随时间而变化或容器中气体的平均相对分子质量不随时间而变化或容器中气体的密度不随时间而变化或v正(N2):v逆(O2)=2:3;
(6)容器内气体的密度增大了0.18g/L,即水的质量减少了0.18g/L×2L=0.36g,则生成氧气物质的量为:$\frac{1}{2}$×$\frac{0.36g}{18g/mol}$=0.01mol,据v(O2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{0.01mol}{2L}}{4min}$=0.00125 mol•L-1min-1,
故答案为:0.00125 mol•L-1min-1.
点评 本题考查了盐类水解、离子检验、化学反应速率计算和影响因素分析、化学平衡标志等,掌握基础是解题关键,题目难度中等.

| A. | c(CO32-)+c(HCO3-)=0.3mol•L-1 | B. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H-) | ||
| C. | c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | D. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
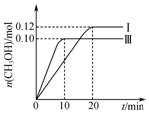 一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )
一定温度下,在三个容积均为2.0L的恒容密闭容器中发生反应:CO(g)+2H2(g)?CH3OH(g),各容器中起始物质的物质的量与反应温度见表,反应过程中容器Ⅰ、Ⅲ中CH3OH的物质的量随时间变化关系如图所示:下列说法正确的是( )| 容器 | 温度/℃ | 起始物质的量/mol | ||
| CO(g) | H2(g) | CH3OH(g) | ||
| Ⅰ | T1 | 0.2 | 0.4 | 0 |
| Ⅱ | T1 | 0 | 0 | 0.4 |
| Ⅲ | T2 | 0.2 | 0.4 | 0 |
| A. | 在前20 min内,容器Ⅰ中反应的平均速率为v(H2)=0.012 mol•L-1•min-1 | |
| B. | 达到平衡后,容器Ⅰ中再充入0.20 mol CO和0.20 mol CH3OH,此时v(正)>v(逆) | |
| C. | 达到平衡时,容器Ⅱ中的压强一定大于容器Ⅰ中的压强的两倍 | |
| D. | 将容器Ⅲ改为绝热容器,实验起始温度为T2,达到平衡时,CO的转化率小于50% |
| A. | 聚氯乙烯塑料制品可用于食品的包装 | |
| B. | 植物油和矿物油都不溶于水,但可用NaOH溶液区分 | |
| C. | “皮革奶”、“人造丝”灼烧时都有烧焦羽毛的气味 | |
| D. | 糖尿病人应少吃含糖类的食品,可常喝糯米八宝粥 |
| A. | ${\;}_{19}^{40}$K 与${\;}_{19}^{39}$K | B. | T2O与H2O | ||
| C. | CH3CH2CH2CH3与 | D. | CH3CH3与CH3CH3CH3 |
 金属有机骨架材料(MOFs)为继碳纳米管后的又一种新型多孔材料.如图所示有机物可用于合成该材料,下列有关该有机物的说法,不正确的是( )
金属有机骨架材料(MOFs)为继碳纳米管后的又一种新型多孔材料.如图所示有机物可用于合成该材料,下列有关该有机物的说法,不正确的是( )| A. | 该有机物能发生加成反应 | |
| B. | 7.8g该有机物含0.2 mol N | |
| C. | 该有机物的一氯代物只有2种 | |
| D. | 分子中的所有原子可能处于同一平面 |
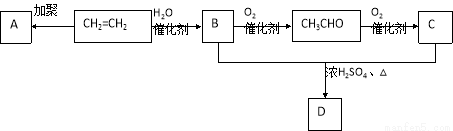
 B的反应类型: ,
B的反应类型: ,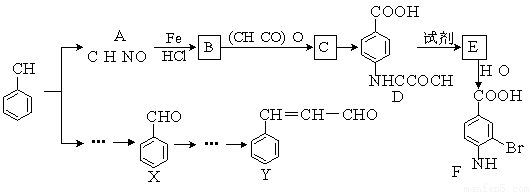
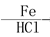
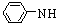
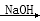 CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO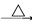 CH3CH=CHCHO
CH3CH=CHCHO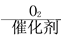 CH3COOH
CH3COOH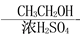 CH3COOCH2CH3
CH3COOCH2CH3