题目内容
下列关于常温下电解质溶液的叙述中,正确的是( )
| A、向0.02mol?L-1 CH3COOH溶液中加入等体积0.01mol?L-1 NaOH溶液,测得溶液中c(CH3COO-)>c(Na+),则水的电离程度比纯水的大 |
| B、25℃时,pH=8的0.1mol?L-1 NaX溶液中由水电离出的c(OH-)=1×10-8mol?L-1 |
| C、等物质的量浓度的NH4Cl溶液和NH3?H2O溶液中,c(NH4+)前者小于后者 |
| D、等物质的量浓度、等体积的氨水和盐酸混合后,c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
考点:弱电解质在水溶液中的电离平衡,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、0.02mol?L-1 CH3COOH溶液中加入等体积0.01mol?L-1 NaOH溶液,得到等物质的量的醋酸和醋酸钠,以醋酸的电离为主;
B、pH=8的0.1mol?L-1 NaX溶液,c(OH-)=
=10-6mol?L-1,而溶液中氢氧根离子全部来自于水的电离;
C、NH4Cl是强电解质完全电离,而NH3?H2O是弱电解质只有极少部分电离;
D、等物质的量浓度、等体积的氨水和盐酸混合后,两者恰好完全反应生成单一的盐氯化铵.
B、pH=8的0.1mol?L-1 NaX溶液,c(OH-)=
| 1×10-14 |
| 10-8 |
C、NH4Cl是强电解质完全电离,而NH3?H2O是弱电解质只有极少部分电离;
D、等物质的量浓度、等体积的氨水和盐酸混合后,两者恰好完全反应生成单一的盐氯化铵.
解答:
解:A、0.02mol?L-1 CH3COOH溶液中加入等体积0.01mol?L-1 NaOH溶液,得到等物质的量的醋酸和醋酸钠,以醋酸的电离为主,溶液呈酸性,对水的电离起抑制作用,则水的电离程度比纯水的小,故A错误;
B、pH=8的0.1mol?L-1 NaX溶液,c(OH-)=
=10-6mol?L-1,而溶液中氢氧根离子全部来自于水的电离,所以水电离出的c(OH-)=1×10-6mol?L-1,故B错误;
C、NH4Cl是强电解质完全电离,而NH3?H2O是弱电解质只有极少部分电离,所以c(NH4+)前者大于后者,故C错误;
D、等物质的量浓度、等体积的氨水和盐酸混合后,两者恰好完全反应生成单一的盐氯化铵,电荷守恒可知c(H+)+c(NH4+)=c(Cl-)+c(OH-),故D正确;
故选D.
B、pH=8的0.1mol?L-1 NaX溶液,c(OH-)=
| 1×10-14 |
| 10-8 |
C、NH4Cl是强电解质完全电离,而NH3?H2O是弱电解质只有极少部分电离,所以c(NH4+)前者大于后者,故C错误;
D、等物质的量浓度、等体积的氨水和盐酸混合后,两者恰好完全反应生成单一的盐氯化铵,电荷守恒可知c(H+)+c(NH4+)=c(Cl-)+c(OH-),故D正确;
故选D.
点评:本题考查弱电解质在水中的电离平衡,盐溶液的pH的计算,弱电解质的电离程度,电荷守恒的应用,难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
已知质量数为A的某阳离子Rn-,核外有X个电子,则核内中子数为( )
| A、A-x | B、A-x-n |
| C、A-x+n | D、A+x-n |
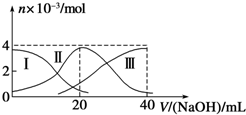 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示.根据图示判断,下列说法正确的是( )| A、当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-) |
| B、等浓度的NaOH溶液与H2A溶液按2:1混合后,其溶液中水的电离程度比纯水小 |
| C、NaHA溶液中:c(OH-)+c(A2-)=c(H+)+c(H2A) |
| D、向上述加入20mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少 |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、17g羟基(-OH)所含有的电子数是10NA个 |
| B、1mol苯乙烯中含有的碳、碳双键数为4NA个 |
| C、常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 |
| D、4.2g C3H6中含有的碳碳双键数一定为0.1NA |
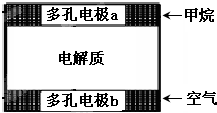 一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )
一种根据燃料电池原理设计瓦斯分析仪工作原理如右图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动并与CO2结合为CO32-.下列有关叙述正确的是( )| A、电极a反应式为:CH4+5O2--8e-=CO32-+2H2O |
| B、电极b是正极,O2-由电极a流向电极b |
| C、瓦斯分析仪工作时,电池内电路中电子由电极a流向电极b |
| D、当固体电解质中有1mol O2-通过时,电子转移4mol |
2014年的南京青奥会将秉持“绿色青奥”这一理念,下列行为不符合这一主题的是( )
| A、推广使用一次性木筷,减少疾病传染 |
| B、推广使用电动汽车、天然气汽车等环保公共交通工具 |
| C、大力发展太阳能和风力发电机可缓解电力紧张问题 |
| D、将地沟油回收加工为燃料油,提高资源的利用率 |
下列说法中,正确的是( )
| A、含有阴离子的化合物一定含有阳离子,含有阳离子的化合物不一定含有阴离子 |
| B、只含化学键而无分子间作用力的化合物晶体一定是原子晶体 |
| C、质子数和电子数均相同的两种微粒不可能是一种分子和一种离子 |
| D、只有分子中所有原子均达到2个或8个电子稳定结构的分子才是稳定分子 |