题目内容
16.V L Al2(SO4)3 溶液中含有 N mol Al3+,则该溶液中SO42-的物质的量浓度为( )| A. | $\frac{N}{V}$ mol•L-1 | B. | $\frac{2N}{3V}$ mol•L-1 | C. | $\frac{N}{2V}$ mol•L-1 | D. | $\frac{3N}{2V}$ mol•L-1 |
分析 先根据化学式 Al2(SO4)3计算出硫酸根离子的物质的量,然后根据c=$\frac{n}{V}$计算出该溶液中SO42-的物质的量浓度.
解答 解:V L Al2(SO4)3 溶液中含有N mol Al3+,则该溶液中含有铝离子的物质的量为:n(SO42-)=$\frac{3}{2}$n(Al3+)=$\frac{3}{2}$×N mol=$\frac{3N}{2}$mol,
则该溶液中SO42-的物质的量浓度为:c(SO42-)=$\frac{\frac{3N}{2}mol}{VL}$=$\frac{3N}{2V}$mol/L,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
4.用惰性电极电解一定量的硫酸铜溶液,实验装置如图甲,电解过程中的实验数据如图乙.横坐标表示转移电子的物质的量,纵坐标表示产生气体的总体积(标准状况).则下列说法不正确的是( )

| A. | 电解过程中,a电极表面先有红色物质析出,后有气泡产生 | |
| B. | b电极上发生的反应方程式为:2H2O+2e-═2OH-+H2↑ | |
| C. | 从P到Q点时收集到的混合气体的平均摩尔质量为12 g/mol | |
| D. | 从开始到P点收集到的气体是O2 |
1.下列排序错误的是( )
| A. | 熔点:石英>食盐>冰>干冰 | |
| B. | 结合质子(H+)能力:OH->HCO-3>CH3COO- | |
| C. | 离子半径:S2->Cl->Al3+>O2- | |
| D. | 热稳定性:HF>HCl>H2S>PH3 |
8.下列各项操作中,发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向Ca(ClO)2溶液中通入过量CO2 ②向AlCl3溶液中逐滴加入过量氨水
③向AgNO3溶液中逐滴加入过量氨水 ④向Na2SiO3溶液中逐滴加入过量的盐酸.
①向Ca(ClO)2溶液中通入过量CO2 ②向AlCl3溶液中逐滴加入过量氨水
③向AgNO3溶液中逐滴加入过量氨水 ④向Na2SiO3溶液中逐滴加入过量的盐酸.
| A. | 只有②③ | B. | 只有①③ | C. | 只有①②③ | D. | ①②③④ |
5.为了出去铁粉中的少量铝粉,可以选用的试剂是( )
| A. | 稀盐酸 | B. | 稀硫酸 | C. | 氯化铜溶液 | D. | 氢氧化钠溶液 |
 .
.
 )为主要成分的天然高分子化合物.天然橡胶有两种,一种是巴西三叶橡胶树产出的橡胶,通常就称为天然橡胶;另一种是杜仲树产出的橡胶,它是我国特产,在湖北等地都有大面积种植,被称为杜仲胶.
)为主要成分的天然高分子化合物.天然橡胶有两种,一种是巴西三叶橡胶树产出的橡胶,通常就称为天然橡胶;另一种是杜仲树产出的橡胶,它是我国特产,在湖北等地都有大面积种植,被称为杜仲胶.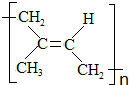 .
.