题目内容
6.对于实验Ⅰ~Ⅳ的描述不正确的是( )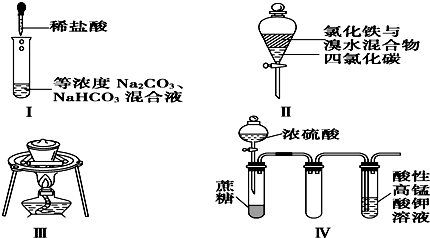
①实验Ⅰ:逐滴滴加稀盐酸时,试管中开始没有立即产生大量气泡
②实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色
③实验Ⅲ:从饱和食盐水中提取氯化钠晶体
④实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去.
| A. | ②③ | B. | ①② | C. | ③④ | D. | ①④ |
分析 ①先发生碳酸钠与盐酸的反应生成碳酸氢钠;
②上层为氯化铁溶液,为黄色;
C.从饱和食盐水中提取NaCl晶体,利用蒸发操作;
D.浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色.
解答 解:①先发生碳酸钠与盐酸的反应生成碳酸氢钠,则开始没有气泡,故①正确;
②四氯化碳的密度比水的大,充分振荡后静置,下层溶液为橙红色,上层为氯化铁溶液,为黄色,故②错误;
③从饱和食盐水中提取NaCl晶体,利用蒸发操作,不需要坩埚,应选蒸发皿,故③错误;
④浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色,观察到性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去,故④正确;
故选A.
点评 本题考查实验方案的评价,涉及到反应的先后顺序、萃取、蒸发等知识点,属于常见的冷拼试题,考查点较多,学生应注意思维的及时转换来解答,题目难度中等.

练习册系列答案
相关题目
10. 中国女药学家屠呦呦因创新性抗疟药青蒿素和双氢青蒿素而获得诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.下列关于青蒿素和双氢青蒿素(结构如图)说法错误的是( )
中国女药学家屠呦呦因创新性抗疟药青蒿素和双氢青蒿素而获得诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.下列关于青蒿素和双氢青蒿素(结构如图)说法错误的是( )
 中国女药学家屠呦呦因创新性抗疟药青蒿素和双氢青蒿素而获得诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.下列关于青蒿素和双氢青蒿素(结构如图)说法错误的是( )
中国女药学家屠呦呦因创新性抗疟药青蒿素和双氢青蒿素而获得诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素-一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”.下列关于青蒿素和双氢青蒿素(结构如图)说法错误的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素和双氢青蒿素均能跟氢氧化钠反应 | |
| D. | 青蒿素分子中含有过氧键和酯基、醚键 |
17.2010年诺贝尔化学奖授予在“钯催化交叉偶联反应”领域作出突出贡献的三位化学家.下列有关钯原子(${\;}_{46}^{106}$Pd)的说法不正确的是( )
| A. | 质量数为106 | B. | 质子数为46 | C. | 电子数为46 | D. | 中子数为46 |
14.元素周期表的形式多种多样,图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( )


| A. | ③元素形成的单质晶体均属于原子晶体 | |
| B. | ②、⑦、⑧对应的简单离子半径依次减小 | |
| C. | ②⑤形成的化合物阴阳离子个数比可能为1:1 | |
| D. | ④元素的气态氢化物易液化,是因为其分子间存在氢键 |
1.下列表示对应化学反应的离子方程式正确的是( )
| A. | Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ | |
| B. | 用惰性电极电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$4H++O2↑+2Cu | |
| C. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 在酸性重铬酸钾溶液中加入少量乙醇3CH3CH2OH+2Cr2O72-+13H+→4Cr3++3CH3COO-+11H2O |
11.组成和结构可用 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )
 表示的有机物共有(不考虑立体结构)( )
表示的有机物共有(不考虑立体结构)( )| A. | 16种 | B. | 28种 | C. | 48种 | D. | 60种 |
18.下列有关试剂的保存方法,错误的是( )
| A. | 浓硝酸保存在棕色玻璃试剂瓶中 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氧化钠溶液保存在带玻璃塞的试剂瓶中 | |
| D. | 新制的氯水通常避光保存在棕色玻璃试剂瓶中 |
15.下列说法正确的是( )
| A. |  和 和  互为同系物 互为同系物 | |
| B. | 乙烷气体中混有乙烯,通入氢气,使乙烯发生加成反应 | |
| C. | 某烃的结构用键线式表示为 ,该烃与Br2按物质的量之比1:1加成时产物有5种 ,该烃与Br2按物质的量之比1:1加成时产物有5种 | |
| D. | 煤经气化和液化两个物理变化过程,可变为清洁能源 |