题目内容
14.元素周期表的形式多种多样,图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是( )
| A. | ③元素形成的单质晶体均属于原子晶体 | |
| B. | ②、⑦、⑧对应的简单离子半径依次减小 | |
| C. | ②⑤形成的化合物阴阳离子个数比可能为1:1 | |
| D. | ④元素的气态氢化物易液化,是因为其分子间存在氢键 |
分析 由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为P、⑦为S、⑧为Cl.
A.碳单质中金刚石为原子晶体,而C60等为分子晶体;
B.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
C.Na2O与Na2O2中阴阳离子个数比均为1:2;
D.氨气分子之间存在氢键,沸点较高,容易液化.
解答 解:由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为P、⑦为S、⑧为Cl.
A.碳单质中金刚石为原子晶体,石墨为混合晶体,而C60等为分子晶体,故A错误;
B.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->Na+,故B错误;
C.Na2O与Na2O2中阴阳离子个数比均为1:2,故C错误;
D.氨气分子之间存在氢键,沸点较高,容易液化,故D正确.
故选D.
点评 本题考查元素周期表及应用,侧重元素的位置及性质的考查,注意对基础知识的理解掌握.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
18.乙基香草醛是食品添加剂的增香原料,它的香味浓郁,其结构简式为 ,下列对该物质叙述正确的是( )
,下列对该物质叙述正确的是( )
 ,下列对该物质叙述正确的是( )
,下列对该物质叙述正确的是( )| A. | 该物质可以进行消去反应 | |
| B. | 该物质可以进行水解反应 | |
| C. | 1 mol该物质最多可与3 mol H2反应 | |
| D. | 该物质可以和Br2进行取代反应 |
5.化合物L是一种能使人及动物的内分泌系统发生紊乱导致生育及繁殖异常的环境激素,它在一定条件下水解可生成双酚A和有机酸M.下列关于L、双酚A和M的叙述中正确的是( )
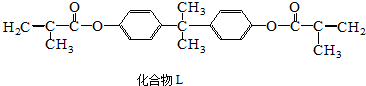

| A. | 1mol L分别与足量NaOH溶液和H2反应,最多可消耗4molNaOH和10molH2 | |
| B. | 有机酸M与油酸互为同系物,双酚A与苯酚互为同系物 | |
| C. | 与M含相同官能团的同分异构体还有2种 | |
| D. | 等物质的量的L、A和M 与足量浓溴水发生反应,消耗Br2的量之比为1:2:1 |
2. 织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出),下列说法错误的是 ( )( )
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出),下列说法错误的是 ( )( )
 织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出),下列说法错误的是 ( )( )
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.25℃时,各组分含量随pH变化情况如图所示(Cl-没有画出),下列说法错误的是 ( )( )| A. | 25℃时,HClO2的电离平衡常数的数值Ka=10-6 | |
| B. | 使用该漂白剂的最佳pH为3.0 | |
| C. | 25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-) | |
| D. | 该温度下NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |
9.下列说法不正确的是( )
| A. | 天然气、酒精和汽油分别属于化石能源、可再生能源和二次能源 | |
| B. | 富含N、P元素的生活用水可以直接用来灌溉农田 | |
| C. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| D. | 我国油品从国 IV 汽油升级到国 V 汽油,有助于减少酸雨、雾霾,提高空气质量 |
19.某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
根据表中数据判断PM2.5待测试样的酸碱性为酸性,试样的pH=4.
(2)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是a、b.
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHS.
(1)将PM2.5样本用蒸馏水处理制成待测试样.
若测得该试样所含水溶性无机离子的化学组分及其平均浓度如表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料.
已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1
写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1.
②洗涤含SO2的烟气.以下物质可作洗涤剂的是a、b.
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHS.
6.对于实验Ⅰ~Ⅳ的描述不正确的是( )
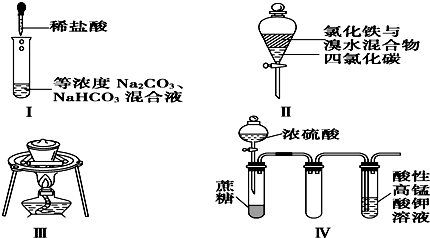
①实验Ⅰ:逐滴滴加稀盐酸时,试管中开始没有立即产生大量气泡
②实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色
③实验Ⅲ:从饱和食盐水中提取氯化钠晶体
④实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去.

①实验Ⅰ:逐滴滴加稀盐酸时,试管中开始没有立即产生大量气泡
②实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色
③实验Ⅲ:从饱和食盐水中提取氯化钠晶体
④实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去.
| A. | ②③ | B. | ①② | C. | ③④ | D. | ①④ |
4.NA为阿伏加德罗常数的值.下列说法中,正确的是( )
| A. | 17 g甲基(-14CH3)所含电子数为10NA | |
| B. | 标准状况下,0.56L丙烷中含有共价键的数目为0.2NA | |
| C. | 在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为5NA | |
| D. | 0.1mol9038Sr原子中含中子数为3.8NA |
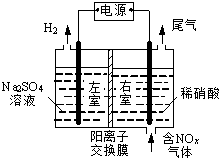 电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).
电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益.实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极).