题目内容
1.下列表示对应化学反应的离子方程式正确的是( )| A. | Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ | |
| B. | 用惰性电极电解CuCl2溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$4H++O2↑+2Cu | |
| C. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液体积混合NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 在酸性重铬酸钾溶液中加入少量乙醇3CH3CH2OH+2Cr2O72-+13H+→4Cr3++3CH3COO-+11H2O |
分析 A.过氧化钠与水反应,过氧化钠既是氧化剂有是还原剂;
B.不符合反应客观事实;
C.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液体积混合反应生成氢氧化铝沉淀、硫酸钡沉淀和一水合氨;
D.酸性环境下,二者反应生成4[Cr(H2O)6]3+和3CH3COOH,据此解答.
解答 解:A.Na2O2加入H218O中,离子方程式:2Na2O2+2H218O=4Na++418OH-+O2↑,故A错误;
B.用惰性电极电解CuCl2溶液,离子方程式:Cu2++2Cl-$\frac{\underline{\;通电\;}}{\;}$Cl2↑+Cu,故B错误;
C.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液体积混合反应生成氢氧化铝沉淀、硫酸钡沉淀和一水合氨,离子方程式:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O,故C正确;
D.在酸性重铬酸钾溶液中加入少量乙醇,离子方程式:2Cr2O72-+3CH3CH2OH+16H++13H2O→4[Cr(H2O)6]3++3CH3COOH,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,注意离子反应遵循客观事实,题目难度中等.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
5.饱和二氧化硫水溶液中存在下列平衡体系:
SO2+H2O?H++HS${O}_{3}^{-}$
HS${O}_{3}^{-}$?H++S${O}_{3}^{2-}$
若向此溶液中( )
SO2+H2O?H++HS${O}_{3}^{-}$
HS${O}_{3}^{-}$?H++S${O}_{3}^{2-}$
若向此溶液中( )
| A. | 加水,S${O}_{3}^{2-}$浓度增大 | |
| B. | 通入少量Cl2气体,溶液pH增大 | |
| C. | 加少量CaSO3粉末,HS${O}_{3}^{-}$ 浓度基本不变 | |
| D. | 通入少量HCl气体,溶液中HS${O}_{3}^{-}$ 浓度减小 |
12.能说明Cl的非金属性比S的非金属性强的事实是( )
| A. | H2S的水溶液中滴加新制氯水后出现浑浊 | |
| B. | Cl原子最外层有7个电子,而S原子最外层有6个电子 | |
| C. | HCl水溶液的酸性强于H2S水溶液的酸性 | |
| D. | HClO4的酸性比H2SO3的酸性强 |
9.下列说法不正确的是( )
| A. | 天然气、酒精和汽油分别属于化石能源、可再生能源和二次能源 | |
| B. | 富含N、P元素的生活用水可以直接用来灌溉农田 | |
| C. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| D. | 我国油品从国 IV 汽油升级到国 V 汽油,有助于减少酸雨、雾霾,提高空气质量 |
6.对于实验Ⅰ~Ⅳ的描述不正确的是( )
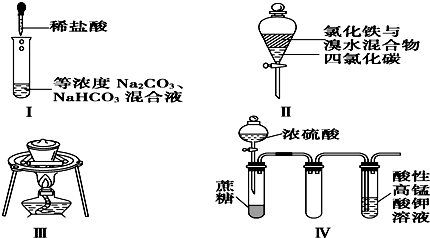
①实验Ⅰ:逐滴滴加稀盐酸时,试管中开始没有立即产生大量气泡
②实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色
③实验Ⅲ:从饱和食盐水中提取氯化钠晶体
④实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去.

①实验Ⅰ:逐滴滴加稀盐酸时,试管中开始没有立即产生大量气泡
②实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色
③实验Ⅲ:从饱和食盐水中提取氯化钠晶体
④实验Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去.
| A. | ②③ | B. | ①② | C. | ③④ | D. | ①④ |
11.常温常压下,50mL三种气态烃的混合物与足量氧气混合点燃爆炸,恢复到原来状况时,体积共缩小100mL,则三种烃可能是( )
| A. | CH4 C2H4 C3H4 | B. | C2H6C3H6 C4H6 | C. | CH4 C2H6 C3H8 | D. | C2H4 C2H6 C3H6 |


 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)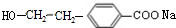 、
、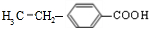 ;
; ;反应⑦的化学方程式为
;反应⑦的化学方程式为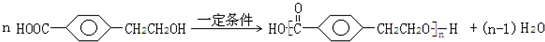 ;
;