题目内容
8.甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)?CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是C(填序号).
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示.
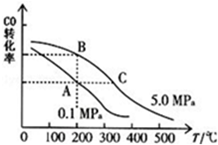
B、C两点的平衡常数K(B)>K(C)(填“>”、“=”或“<”).
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率=75%,此温度下的平衡常数K=1.3.(保留二位有效数字).
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V<20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小顺序c(Na+)>c(HCOO-)>c(OH-)>c(H+)
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为O2+4e-+2CO2=2CO32-.
(4)己知:CH3OH、H2的燃烧热(△H)分别为-726.5kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-130.9 kJ/mol.
分析 (1)①可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
②由图可知,B、C处于等压线上,随温度升高CO转化率减小,说明升高温度平衡逆向移动;
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,则:
CO(g)+2H2(g)?CH3OH(g)
起始浓度(mol/L):1 3 0
变化浓度(mol/L):0.75 1.5 0.75
平衡浓度(mol/L):0.25 1.5 0.75
CO的转化率=$\frac{CO浓度变化量}{CO起始浓度}$×100%,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$;
(2)HCOOH是弱电解质,NaOH是强电解质,若二者恰好完全反应生成HCOONa,溶液呈碱性,现在溶液呈中性,故HCOOH应有剩余;
恰好完全反应生成HCOONa,溶液中HCOO-水解,溶液呈碱性;
(3)原电池正极发生还原反应,氧气在正极获得电子,与二氧化碳结合生成碳酸根离子;
(4)CH3OH、H2的燃烧热(△H)分别为-726.5kJ/mol、-285.8kJ/mol,可得热化学方程式:
①CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1,
由盖斯定律可知,3×②-①可得:CO2(g)+3H2(g)=CH3OH(l)+H2O(l).
解答 解:(1)①A.每消耗1molCO的同时生成2molH2,生成2molH2的同时可以生成1molCO,CO的消耗速率与生成速率相等,反应到达平衡状态,故A正确;
B.该反应是一个前后气体物质的量变化的反应,当混合气体总物质的量不变,达到化学平衡状态,故B正确;
C.生成CH3OH的速率与消耗CO的速率相等,均表示正反应速率,反应始终按该比例关系进行,故C错误;
D.CH3OH、CO、H2的浓度都不再发生变化,说明到达化学平衡状态,故D正确,
故选:C;
②由图可知,B、C处于等压线上,随温度升高CO转化率减小,说明升高温度平衡逆向移动,所以平衡常数减小,所以K(B)>K(C),故答案为:>;
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,则:
CO(g)+2H2(g)?CH3OH(g)
起始浓度(mol/L):1 3 0
变化浓度(mol/L):0.75 1.5 0.75
平衡浓度(mol/L):0.25 1.5 0.75
CO的转化率=$\frac{0.75mol/L}{1mol/L}$×100%=75%,平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{0.75}{0.25×1.{5}^{2}}$≈1.3,
故答案为:75%;1.3;
(2)CH3COOH是弱电解质,NaOH是强电解质,反应生成的甲酸钠是强碱弱酸盐,水解呈碱性,反应后溶液呈中性pH=7,故HCOOH应有剩余,由于二者浓度相等且按物质的量1:1反应,故V<20.00mL;
恰好完全反应生成HCOONa,溶液中HCOO-水解,溶液呈碱性,甲酸根离浓度减小,溶液中离子浓度大小关系为:c(Na+)>c(HCOO-)>c(OH-)>c(H+);
故答案为:<;c(Na+)>c(HCOO-)>c(OH-)>c(H+);
(3)原电池正极发生还原反应,氧气在正极获得电子,与二氧化碳结合生成碳酸根离子,正极电极反应式为:O2+4e-+2CO2=2CO32-,
故答案为:O2+4e-+2CO2=2CO32-;
(4)CH3OH、H2的燃烧热(△H)分别为-726.5kJ/mol、-285.8kJ/mol,可得热化学方程式:
①CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1,
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1,
由盖斯定律可知,3×②-①可得:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-130.9 kJ/mol,
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-130.9 kJ/mol.
点评 本题考查化学平衡计算、化学平衡状态的判断、化学平衡常数、离子浓度大小比较、电极方程式的书写、热化学方程式的书写等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.

| X | |
| Y | Z |
| A. | 原子半径Z>Y>X | |
| B. | 氢化物的稳定性X>Y、Z>Y.可能X>Z | |
| C. | 最高价氧化物对应的水化物酸性Z>Y>X | |
| D. | 三种元素形成的简单离子半径X<Y<Z |
| A. | 已知:HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol,则氢气的燃烧热为△H=-285.8 kJ/mol | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知 2H2O(g)+O2(g)=2H2O2(l)△H=+108.3kJ/mol ① N2H4(l)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ/mol ② 则有反应:N2H4(l)+2H2O2(l)=N2(g)+4H2O(l)△H=-642.3kJ/mol | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-57.4 kJ/mol |

