题目内容
把金属钠放置在空气中,最终会变成( )
| A、NaOH |
| B、Na2CO3 |
| C、Na2O |
| D、Na2O2 |
考点:钠的化学性质
专题:元素及其化合物
分析:金属钠置于空气中,切口开始呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3.10H2O)→最后变成Na2CO3粉(风化),以此来解答.
解答:
解:金属钠置于空气中,切口开始呈银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3.10H2O)→最后变成Na2CO3粉(风化),有关反应如下:4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO3.10H2O、Na2CO3.10H2O=Na2CO3+10H2O,即最终会变成Na2CO3,
故选B.
故选B.
点评:本题考查钠的化学性质,为高频考点,把握发生的一系列化学反应为解答的关键,注意钠的化合物的性质及在溶液中碳酸钠可转化为碳酸氢钠,题目难度不大.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A、常温常压下,18g NH4+所含的电子数为10NA |
| B、56g金属铁与氯气反应时得到的电子数为3NA |
| C、标准状态下,22.4L氧气所含的氧原子数为2NA |
| D、1mol由Na2O2和Na2O组成的混合物,其中的钠离子数为4NA |
下列化学用语表达不正确的是( )
A、氨分子的电子式: |
B、S2-的离子结构示意图: |
| C、CO2分子的结构式:O=C=O |
D、苯分子的结构简式: |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A、14g分子通式为CnH2n的链烃中含有的C═C的数目为
| ||
| B、标准状况下,NO和 O2各11.2L 混合,所得混合气体的分子总数为 0.75NA | ||
| C、25℃时,pH=7的NH4Cl和NH3?H2O混合溶液中,OH-离子数为10-7NA | ||
| D、两份2.7g铝分别与100mL浓度为2mol?L-1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA |
关于反应2Na2O2+2CO2=2Na2CO3+O2↑ 的说法正确的是( )
| A、该反应的还原剂是CO2 |
| B、该反应的氧化剂是Na2O2,发生氧化反应 |
| C、氧化剂和还原剂的物质的质量比为39:22 |
| D、若有2 mol Na2O2参加反应,则转移电子2 mol |
下列有关物质性质的比较顺序中,不正确的是( )
| A、熔点:F2<Cl2<Br2<I2 |
| B、微粒半径:F->Na+>Mg2+>Al3+ |
| C、酸性HClO4>H2SO4>H3PO4>H2SiO3 |
| D、热稳定性:HF<HCl<HBr<HI |
可逆反应达到平衡的重要特征是( )
| A、反应停止了 |
| B、正、逆反应的速率相等 |
| C、反应物和生成物的浓度相等 |
| D、正、逆反应速率都为零 |
下列说法正确的是( )
| A、含有共价键的化合物必是共价化合物 |
| B、吸热反应在不加热的条件下一定不能发生 |
| C、放热反应在常温下一定很容易发生 |
| D、双原子单质分子中的共价健一定是非极性键 |
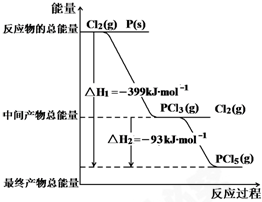 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示( 图中的△H表示生成1mol产物的数据).根据图示,回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示( 图中的△H表示生成1mol产物的数据).根据图示,回答下列问题: