题目内容
20.完成以下题目(1)铜锌电池(稀硫酸做电解质溶液)的正极反应2H++2e-=H2↑;
(2)铅蓄电池放电时的负极反应Pb-2e-+SO42-=PbSO4;
(3)精炼铜的阳极材料为粗铜;
(4)电解食盐水的离子反应方程式2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-.
分析 (1)Cu、Zn和稀硫酸构成的原电池中,正极上氢离子得电子发生还原反应;
(2)铅蓄电池放电时,负极上铅失电子发生氧化反应;
(3)电解精炼粗铜时,阳极材料是粗铜;
(4)电解饱和食盐水时,阳极上氯离子放电生成氯气、阴极上水得电子生成氢气和氢氧根离子.
解答 解:(1)Cu、Zn和稀硫酸构成的原电池中,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)铅蓄电池放电时,负极上铅失电子发生氧化反应,电极反应式为Pb-2e-+SO42-=PbSO4,故答案为:Pb-2e-+SO42-=PbSO4;
(3)电解精炼粗铜时,阳极材料是粗铜,阴极是纯铜,故答案为:粗铜;
(4)电解饱和食盐水时,阳极上氯离子放电生成氯气、阴极上水得电子生成氢气和氢氧根离子,离子方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH-.
点评 本题考查电极反应式的书写,为高频考点,明确各个电极上发生的反应及离子放电顺序是解本题关键,注意电极反应式书写要结合电解质溶液酸碱性,题目难度不大.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
11.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生如下反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
①写出该反应的逆反应的平衡常数表达式:K=$\frac{c{\;}^{2}(N{\;}_{2}O{\;}_{5})}{{c}^{4}(NO{\;}_{2})•c(O{\;}_{2})}$.
已知:K300℃>K350℃,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有BC.
A.再充入NO2 B.再充入4mol NO2和1mol O2
C.降低温度 D.充入氦气
③图1中表示N2O5的浓度的变化曲线是c;
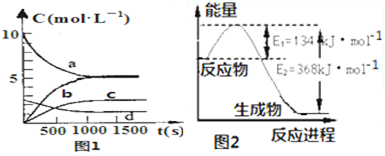
(2)图2是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图;又已知:
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-760.3kJ•mol-1,
则反应:N2 (g)+2NO2 (g)?4NO(g) 的△H=+292.3kJ•mol-1.
(1)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生如下反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
已知:K300℃>K350℃,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有BC.
A.再充入NO2 B.再充入4mol NO2和1mol O2
C.降低温度 D.充入氦气
③图1中表示N2O5的浓度的变化曲线是c;

(2)图2是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图;又已知:
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-760.3kJ•mol-1,
则反应:N2 (g)+2NO2 (g)?4NO(g) 的△H=+292.3kJ•mol-1.
11.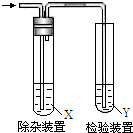 欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
 欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )
欲要检验不同条件下制得的乙烯,四个实验小组均用图所示装置对所制得的进行除杂、检验,所用试剂X、Y分别见下表所示.你认为设计中不需要除杂的小组是( )| 小组 | 乙烯的制备 | 试剂X | 试剂Y |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| C | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓硫酸加热至170℃ | NaOH溶液 | Br2的CCl4 |
| A. | A | B. | B | C. | C | D. | D |
8.下列说法不正确的是( )
| A. | 丙烯的结构简式:C3H6 | |
| B. | Al3+能水解成Al(OH)3胶体,明矾可用作净水剂 | |
| C. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| D. | 盛有被KCl饱和溶液浸泡过的琼脂的U型管,可用作原电池的盐桥 |
15.常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;③pH=11的氨水;④pH=11的NaOH溶液.下列说法正确的是( )
| A. | ④和②混合溶液中:c(H+)=c(OH-) | |
| B. | ①与④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | ②和③混合溶液中:c(H+)>c(OH-) | |
| D. | 四种溶液稀释100倍,溶液pH:③>④>②>① |
5.下列实验原理、操作方法或结论等存在错误的是( )
| A. | 已知:I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 | |
| B. | 室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚 | |
| C. | “硝基苯制备”实验中,浓硫酸起到催化作用 | |
| D. | 用溴水验证裂化汽油中含有不饱和烃 |
12.在100℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下:[2NO2(g)?N2O4(g)△H<0],下列说法正确的是( )
| 容器 | 物质 | 起始浓度/(mol•L-1) | 平衡浓度/(mol•L-1) |
| Ⅰ | N2O4 | 0.100 | 0.040 |
| NO2 | 0 | 0.120 | |
| Ⅱ | N2O4 | 0 | 0.014 |
| NO2 | 0.100 | 0.072 |
| A. | 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4)<α(NO2) | |
| B. | 平衡时,升高温度,Ⅰ中速率减慢,Ⅱ中速率加快 | |
| C. | 当密度不变时,上述反应即达平衡 | |
| D. | 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深 |
9.下列措施对增大反应速率明显有效的是( )
| A. | Na与水反应时增大水的用量 | |
| B. | Fe与稀硫酸反应制取H2 时,改用浓硫酸 | |
| C. | 在K2SO4与BaCl2两溶液反应时,降低温度 | |
| D. | Al与氧气燃烧生成Al2O3,将Al片改为Al粉, |
10.下列有关化学实验的叙述中,不正确的是( )
| A. | 淀粉水解的最终产物是葡萄糖 | |
| B. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 | |
| C. | 盐析可提纯蛋白质并能保持蛋白质的生理活性 | |
| D. | 油脂都不能使溴水褪色 |