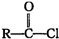
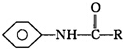
题目内容
三氯化铁水解的离子方程式为 ,配制三氯化铁溶液时滴加少量盐酸的作用是 ;若向三氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色无味气体,其离子方程式为: ,同时有红褐色沉淀生成的原因是 .
考点:盐类水解的应用
专题:
分析:FeCl3属于强酸弱碱盐,铁离子水解生成氢氧化铁和氢离子导致其溶液呈酸性,加入酸能抑制其水解;水解生成的HCl能和碳酸钙反应生成氯化钙、二氧化碳和水;生成的HCl发生反应从而促进氯化铁水解.
解答:
解:FeCl3属于强酸弱碱盐,铁离子水解生成氢氧化铁和氢离子导致其溶液呈酸性,离子方程式为Fe3++3H2O?Fe(OH)3+3H+,加入酸后,溶液中氢离子浓度增大能抑制其水解;水解生成的HCl能和碳酸钙反应生成氯化钙、二氧化碳和水,离子方程式为CaCO3+2H+=CO2↑+Ca2++H2O;生成的HCl发生反应从而促进氯化铁水解,最终生成氢氧化铁红褐色沉淀,
故答案为:Fe3++3H2O?Fe(OH)3+3H+;抑制FeCl3水解;CaCO3+2H+=CO2↑+Ca2++H2O;生成的HCl发生反应从而促进氯化铁水解.
故答案为:Fe3++3H2O?Fe(OH)3+3H+;抑制FeCl3水解;CaCO3+2H+=CO2↑+Ca2++H2O;生成的HCl发生反应从而促进氯化铁水解.
点评:本题以氯化铁为载体考查盐类水解,明确盐类水解原理是解本题关键,知道促进或抑制水解的方法,题目难度不大.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
将氯水注入KI溶液中,用力振荡,再注入四氯化碳,振荡后静置,看到的现象是( )
| A、液体呈无色 |
| B、液体分两层,上层为紫色,下层接近无色 |
| C、液体呈紫红色 |
| D、液体分两层,上层接近无色,下层为紫色 |
下列各组反应,实质都是取代反应的是( )
| A、苯硝化,苯酚和溴水反应,皂化反应,乙烯与溴水反应 |
| B、酯的水解,酯化反应,乙醇和氢卤酸反应,乙醇和浓硫酸加热至140℃时的反应 |
| C、淀粉在硫酸存在下制葡萄糖,醛的氧化或还原 |
| D、纤维素水解,浓硫酸和乙醇在170℃时的反应,蛋白质水解 |
用石墨作电极电解CuCl2溶液,当通电一段时间后,阳极收集到2.24L气体(标准状况).下列有关说法正确的是( )
| A、阴极生成的铜为5.6g |
| B、上述电解过程中共转移0.2 mol电子 |
| C、电解得到的Cu的物质的量为0.5mol |
| D、电解后溶液呈碱性 |
将5.6g铁粉投入盛有100mL 2mol?L-1 稀硫酸的烧杯中,2min 时铁粉刚好溶解完全.如果反应前后溶液的体积不变,则该反应的平均速率可表示为( )
| A、v(Fe)=0.5 mol?L-1?min-1 |
| B、v(H2SO4)=1 mol?L-1?min-1 |
| C、v(H2)=1 mol?L-1?min-1 |
| D、v(FeSO4)=0.5 mol?L-1?min-1 |
在一支25ml的碱式滴定管中,盛装溶液时液面恰好在10.00ml处.若将管内液体全部放出,所得溶液的体积为( )
| A、10.00ml |
| B、15.00ml |
| C、大于15.00ml |
| D、小于15.00ml |
25℃时,水中存在电离平衡:H2O?H++OH-△H>0.下列叙述正确的是( )
| A、升高温度,Kw增加,pH增大 |
| B、向水中加入少量NaOH固体,平衡向逆方向移动,c(OH-)增大 |
| C、向水中加入少量CH3COONa固体,平衡向正方向移动,c(H+)增大 |
| D、25℃时,纯水中c(H+)>10-7mol/L |
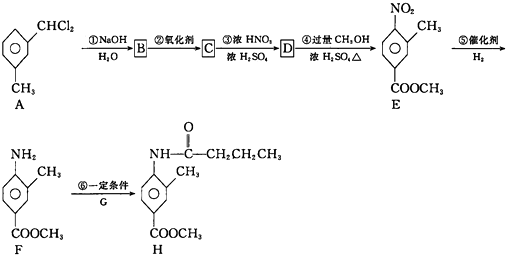
 +
+