题目内容
1.下列盐的水溶液呈酸性的是( )| A. | K2SO4 | B. | CaCl2 | C. | CuCl2 | D. | NaHCO3 |
分析 盐溶液呈酸性,可能有两种情况,一是水解呈酸性,为强酸弱碱盐,二是酸式盐,电离程度大于水解程度,以此解答.
解答 解:A.K2SO4为强酸强碱盐,不水解溶液呈中性,故A错误;
B.氯化钙为强酸强碱盐,溶液呈中性,故B错误;
C.氯化铜为强酸弱碱盐,水解呈酸性,故C正确;
D.碳酸氢钠为强碱弱酸盐,水解大于电离溶液呈碱性,故D错误.
故选C.
点评 本题考查盐类水解的应用,为高频考点,注意把握盐类水解的规律,根据对应酸、碱的电解质的强弱判断水解的情况,可判断溶液的酸碱性,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
11.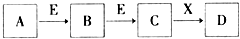 中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )
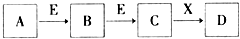 中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )
中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去).下列推断不正确的是( )| A. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| B. | 若D为NaCl,且A可与C反应生成B,则E可能是CO2 | |
| C. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁 | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
12.下列说法不正确的是( )
| A. | 增大反应物浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的化学反应,增大压强(缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大单位体积内活化分子的百分数,从而成千上万倍地增大化学反应速率 |
9.下列图示与对应的叙述相符的是( )
| A. | 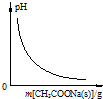 图表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化 | |
| B. | 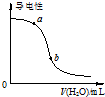 图表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b | |
| C. | 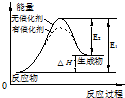 图表示催化剂能改变化学反应的焓变 | |
| D. | 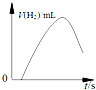 图表示表面有氧化膜的镁条投入稀盐酸中产生氢气的速率随时间的变化曲线 |
16.海藻中含丰富的、以离子形式存在的碘元素.如图是实验室从海藻里提取碘的流程的一部分,下列判断正确的是( )
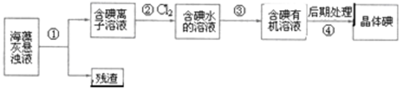

| A. | 步骤①、③的操作分别是过滤、萃取分液 | |
| B. | 可用淀粉溶液检验步骤②的反应是否进行完全 | |
| C. | 步骤③中加入的有机溶剂是乙醇 | |
| D. | 步骤④的操作是过滤 |
6.下列不属于盐的是( )
| A. | NH4Cl | B. | MgO | C. | Fe2(SO4)3 | D. | NaHCO3 |
13.金属铜的提炼多从黄铜矿(CuFeS2)开始,已知黄铜矿中铁为+2价.黄铜矿的焙烧过程中发生的主要反应为:2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是( )
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2既是氧化剂又是还原剂 | |
| C. | O2只做氧化剂 | |
| D. | 若有1mol O2参加反应,则反应中有4mol电子转移 |
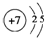 ;
;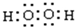 ,
,